3D打印定制化植入物在复杂骨科手术中,特别是骨肿瘤修复手术中,已逐渐成为刚性需求。
作为一种医疗器械,3D打印定制化骨科植入物需要遵循医疗器械监督管理规定,方可在临床中进行应用。根据3D科学谷的市场观察,2020年1月1日,《定制式医疗器械监督管理规定(试行)》(以下简称“规定”)正式实施。该规定使得3D打印定制化骨科植入物在接受监管的过程中有依据可寻,促进3D打印定制化骨科植入物技术在临床中的应用发展。
本期,3D科学谷根据国家药品监督管理局对于规定的解读,对其中与3D打印应用相关的关键点进行了整理。
规定指出,个性化医疗器械是指医疗器械生产企业根据医疗机构经授权的医务人员提出的临床需求设计和制造的、满足患者个性化要求的医疗器械,分为定制式医疗器械和患者匹配医疗器械。
规定指出,定制式医疗器械具有以下特点:一是用于诊断治疗罕见特殊病损情况,预期使用人数极少,没有足够的人群样本开展临床试验;二是我国已上市产品难以满足临床需求;三是由临床医生提出,为满足特殊临床需求而设计生产;四是用于某一特定患者,预期能提高诊疗效果。
规定指出,患者匹配医疗器械是指医疗器械生产企业在依据标准规格批量生产医疗器械产品基础上,基于临床需求,按照验证确认的工艺设计和制造的、用于指定患者的个性化医疗器械。患者匹配医疗器械具有以下特点:一是在依据标准规格批量生产医疗器械产品基础上设计生产、匹配患者个性化特点,实质上可以看作标准化产品的特定规格型号;二是其设计生产必须保持在经过验证确认的范围内;三是用于可以进行临床研究的患者人群。如定制式义齿、角膜塑形用硬性透气接触镜、骨科手术导板等。
个性化与定制式是两个易于混淆的概念。从以上定义可以看出,定制式医疗器械是个性化医疗器械的一种,而依据标准规格设计的患者匹配型医疗器械也属于个性化产品。定制式医疗器械仅供提出特殊需求出具订单的医疗机构用于指定患者,非订单机构或非指定患者不得使用。
定制式医疗器械适用《定制式医疗器械监督管理规定(试行)》,而患者匹配型医疗则不适用该规定,需要另外按照《医疗器械注册管理办法》《体外诊断试剂注册管理办法》的规定进行注册或者备案,注册/备案的产品规格型号为所有可能生产的尺寸范围。
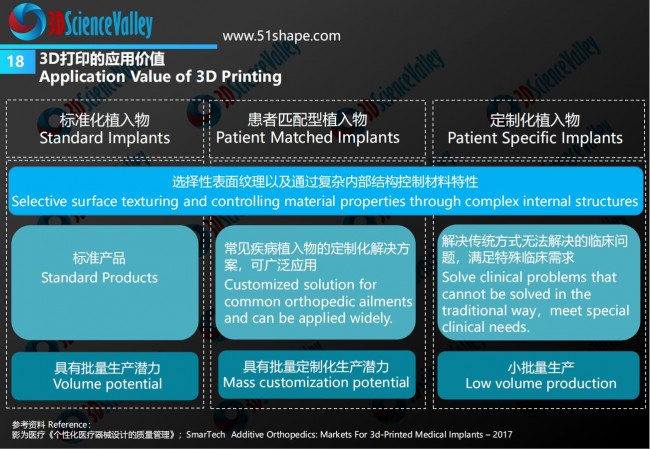
根据3D科学谷的市场研究,3D打印技术在骨科植入物制造中的应用可以分为:标准化植入物、患者匹配型植入物和定制化植入物。根据规定中的定义,其中为解决传统方式无法解决的临床问题的3D打印定制化植入物,属于《定制式医疗器械监督管理规定(试行)》的适用范围。
与标准化批量生产的医疗器械不同,定制式医疗器械无需经过漫长的实验与审批管理周期,而是按规定实行上市前备案管理。
定制式医疗器械生产企业与医疗机构共同作为备案人,在生产、使用定制式医疗器械前应当向医疗器械生产企业所在地(进口产品为代理人所在地)省、自治区、直辖市药品监督管理部门备案。从风险控制的角度出发,定制式医疗器械不得委托生产,备案人应当具备相应条件。
在保护患者隐私的情况下,生产企业应当将定制式医疗器械产品设计环节延伸到医疗机构。
定制式医疗器械研制、生产除符合医疗器械生产质量管理规范及相关附录要求外,还应当满足以下特殊要求:1.人员;2.设计开发;3.质量控制;4.追溯管理。
规定指出,当定制式医疗器械临床使用病例数及前期研究能够达到上市前审批要求时,相关生产企业应当按照《医疗器械注册管理办法》《体外诊断试剂注册管理办法》规定,申报注册或者办理备案。符合伦理准则且真实、准确、完整、可溯源的临床使用数据,可以作为临床评价资料用于注册申报。
例如,金属3D打印定制式颈椎融合体,在临床应用一定例数、产品基本定型后,可以作为患者匹配医疗器械申报注册。患者匹配型植入物,属于常见疾病植入物的定制化解决方案,进入到这一阶段时,3D打印的应用将属于植入物产品批量定制化生产应用。
有关规定中公布的更多定制式医疗器械监督管理细则,请参考《定制式医疗器械监督管理规定(试行)》。3D打印技术在骨科植入物制造领域的应用,请参考3D打印与骨科植入物白皮书2.0。
《定制式医疗器械监督管理规定(试行)》与定制式医疗器械团体标准,可前往3D科学谷产业链QQ群:529965687 群文件中进行下载。
参考资料:
《定制式医疗器械监督管理规定(试行)》解读 http://www.nmpa.gov.cn/WS04/CL2201/338729.html
白皮书下载,加入3D科学谷产业链QQ群:529965687
网站投稿请发送至2509957133@qq.com
欢迎转载,长期转载授权请留言