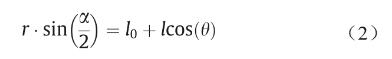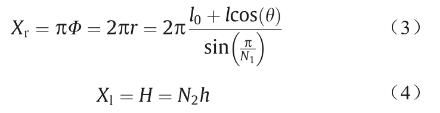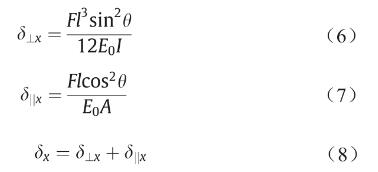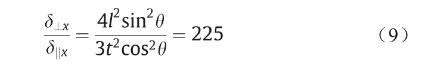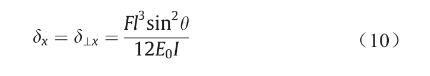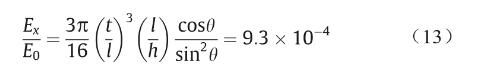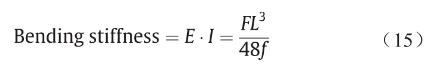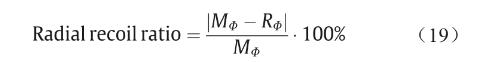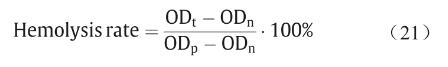根据中国工程院院刊Engineering,药物洗脱支架固有的缺陷促进了生物可吸收心血管支架的研究与发展。近年来,增材制造技术(也称3D打印技术)在医疗器械领域得到了广泛的应用。论文《轴向零泊松比结构心血管支架的设计、3D打印与表征》提出了一种新型的微螺杆挤出式3D打印系统,并利用该系统制备了一种具有零泊松比(ZPR)结构的支架。
首先进行了初步的单丝挤出试验来研究合适的制造参数;随后,制备了具有不同几何结构的3D打印支架,并通过扫描电子显微镜(SEM)观察分析支架表面形貌;最后,对不同参数的3D打印支架进行了力学性能评价和初步的生物学评价。总之,基于微螺杆挤出式3D打印系统具有制备个性化支架的潜力。
本期谷.专栏将对这一研究成果的核心内容进行分享。
论文研究由北京市自然科学基金(Z150001)资助,北京市安贞医院提供支持。
https://www.engineering.org.cn/ch/10.1016/j.eng.2020.02.013
药物洗脱支架(drug-eluting stents, DES)已成为心血管疾病介入治疗的金标准,通过包被于金属支架表面的聚合物携带抗增生的药物,DES植入后缓慢释放药物,抑制平滑肌细胞增殖,明显降低术后再狭窄率[1–3]。但药物释放后所遗留的金属支架长期存留于血管中,阻碍血管修复,易于诱发血管局部炎症反应,患者需长期服药,且仍存在植入晚期的血栓形成以及再狭窄的风险[4,5]。
生物可降解支架(bioresorbable stents, BRS)在植入后9~12个月内为狭窄处血管提供机械性支撑,借助洗脱出的药物,防止再狭窄;随后支架缓慢降解,而血管逐渐恢复舒缩功能。BRS在一定程度上减少长期服药的需要,避免了植入晚期的炎症、血栓等不良反应,为后续的再次治疗提供了可能性[6,7]。激光切割加工是金属支架加工的常规手段,这种工艺在BRS加工中同样得到应用。Stepak等[8]研究了不同激光加工参数对聚乳酸[poly(l-lactide) acid, PLLA]聚合物支架质量和几何形状的影响。Guerra等[9]研究了用激光切割聚己内酯(polycaprolactone, PCL)薄片的可行性,作为支架制造的可行性研究。然而,激光加工可能会导致支架产生微裂纹、浮渣沉积等热损伤[10,11]。更重要的是,激光切割作为一种减材制造方法,不适合个性化定制。
3D打印技术已逐渐发展成为一种通用性、经济性的个性化医疗器械制造技术。Kaesemeyer等[12]使用一种四运动轴熔融挤压系统制备了一种由丙交酯、乙交酯、己内酯、洛伐他汀等按照60 ∶ 15 ∶ 10 ∶ 15的质量比组成的生物可吸收支架。Park等[13]将具有药物涂层的3D打印PCL支架植入猪股动脉,取得了积极的动物体内植入结果。Guerra等[10]提出一种通过挤出PCL 丝材来制备生物可降解支架的新型3D打印设备,并研究了加工参数对支架性能的影响。Wu等[14]使用熔融沉积成型(fused deposition modeling, FDM)打印机和 PLLA丝材打印了具有负泊松比结构的PLLA支架,并研究了PLLA支架的径向压缩性能。上述研究证实了 3D打印用于生物可降解心血管支架的可行性,但是仍存在一些局限性。上述研究制备的支架具有均一的直径(圆柱形支架)。此外,支架通常会发生轴向缩短(支架长度随着支架扩张而收缩),因此临床医生必须选择比植入堵塞部位长度更长的支架。然而,径向扩张的程度和支架扩张后的最终长度因人而异。因此,支架长度的选择需要取决于医生的经验判断,这可能会出现偏差并导致支架错位。更严重的是,支架过度缩短会在支架末端和血管内壁之间产生摩擦,导致血管内皮层损伤[15]。
本文中,研究人员开发了一种新型微螺杆挤出式3D打印系统,提出了一种新型零泊松比(zero Poisson’s ratio, ZPR)结构心血管支架,并对微螺杆挤出打印设备的制造工艺参数进行初步探究。通过改变第四轴旋转轴的直径、长度和形状,制备不同材料、直径和几何参数的支架,进一步研究3D打印成型参数对PCL支架的表面形貌、支架参数和力学性能的影响。
支架基本结构由环状支撑体和连接每相邻支撑体的连接体组成。一般环状支撑体采用Z形环结构[16]。支架在扩张或压缩的过程中,Z形环随之扩张或压缩,支架的径向强度主要与Z形环结构相关;连接体结构决定着支架介入过程中经过弯曲血管处的难易程度,支架的弯曲性能主要与连接体相关。在临床应用中,血管支架在膨胀过程中存在一定程度的长度缩短现象,通过特定的支架结构设计可改善这一缺陷。
为解决支架扩张时轴向缩短问题,我们设计了如图 1所示的ZPR结构支架。该支架结构单元[图1(a)]与 Attard等[17]报道的半凹形马蜂窝ZPR结构相似。泊松比(ν)定义为外力加载方向上的横向应变(εi )与轴向应变(εj )之比。泊松比可用式(1)表示:
支架结构单元尺寸可通过以下参数表示:图片代表Z形环斜杆长度;θ代表Z形环张开角度(斜杆倾斜角度); h代表连接杆长度;t代表连接杆宽度;图片代表相邻的斜杆距离的一半。图1(b)为支架结构二维展开图,将图 1(b)所示的网格卷成管状,如图1(c)所示,Φ和H 分别代表支架直径和高度(连接杆长度之和)。这里引入N1和N2分别作为周向和轴向的结构单元数。
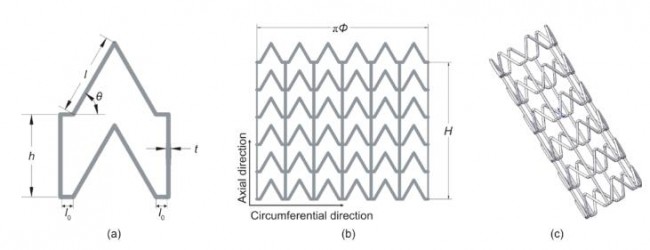 图1.零泊松比支架结构设计。(a)支架结构单元;(b)支架结构二维展开图;(c)支架三维结构图。
图1.零泊松比支架结构设计。(a)支架结构单元;(b)支架结构二维展开图;(c)支架三维结构图。
© Engineering
支架受径向作用力而扩张或压缩。如图2所示,θ随 r(支架半径)的变化而增加,具体可表达为:
式中,α=2π/N1。如图1(b)所示,支架在径向方向(图片 )和轴向方向(图片 )的长度可表示如下:
假设支架径向方向受到微小的作用力,θ随之产生微小的变化dθ,此时支架在径向方向(图片)和轴向方向(图片)的应变可以表示为:
式中,图片 代表在 Xi 方向上的变形,i = r,1。
从图2(c)可以看出,支架扩张时直径的变化主要取决于Z形环斜杆的变形。因此,我们在这里主要讨论斜杆在载荷作用下的变形。长度为图片的斜杆可以简化为悬臂梁,该悬臂梁的一端受力而移动,另一端则被固定 [图2(d)] [18]。斜杆在x方向的变形δx可分解为由垂直于杆的力带动杆转动产生的位移在x方向的分量δ丄x和由平行于杆的力导致杆变形所产生的形变在x方向的分量 δ║x,可表示如下[19,20]:
式中,E0 为支架材料弹性模量;I = πt 4 /64为杆的惯性矩;t为支架斜杆的直径;A = πt 2 /4为斜杆的截面面积。
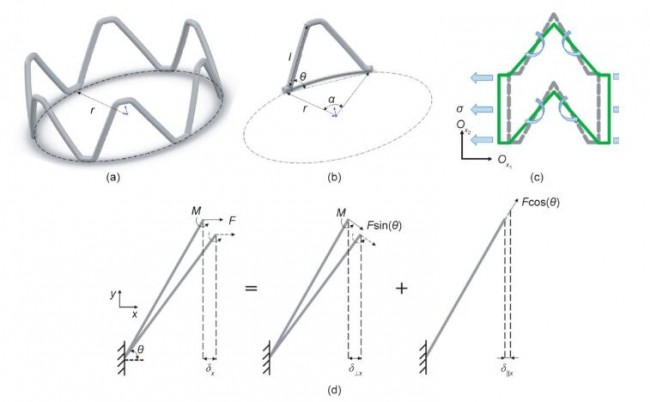 图2. Z形环斜杆变形示意图。(a)Z形环结构;(b)Z形环结构单元;(c)支架变形时二维单元变形示意图;(d)受力矩与轴向力作用下斜杆变形示意图。
图2. Z形环斜杆变形示意图。(a)Z形环结构;(b)Z形环结构单元;(c)支架变形时二维单元变形示意图;(d)受力矩与轴向力作用下斜杆变形示意图。
© Engineering
在本研究中,图片、t和θ一般分别取1.5 mm、0.2 mm和60°。因此,可得知
可见,相对于δ丄x ,δ║x 是一个小量,在此可以忽略。因此,斜杆在x方向的变形及应变可表示为:
图2(d)中斜杆在x方向应变为:

力F可表达为F = σth,将I = πt 4 /64代入,可得到斜杆在x方向的等效弹性模量为:
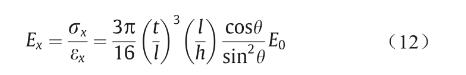
代入图片 = 1.5 mm、t = 0.2 mm、h = 1.5 mm和θ= 60°,可得:
在本研究中,当支架扩张时,支架受径向力与图2(c)中的图片 平行,支架结构泊松比为:
由dX1 /dθ = 0,可得图片=0。
因此,将ZPR结构引入支架结构,理想情况下,支架长度在扩张过程中不改变。此外,由式(1)~(13)可知,在支架扩张过程中,仅存在支架结构的变形,支架材料不发生形变。支架强度取决于斜杆的抗变形能力,由此可见,支架强度与斜杆长度图片、连接杆长度h、杆直径t以及斜杆初始张开角度θ相关,具体而言支架强度与图片 成反比,与连接杆长度h成反比,与t3 成正比。
3.1. 系统组成
3D打印因其个性化成型、快速便捷、材料利用率高等优点,在医疗领域得到了充分的发展与应用。医用级生物可降解材料如PCL、PLLA等,多为热塑性材料,适合采用FDM技术成型。常规FDM设备多采用丝材打印,因此要求原材料在成型前加工成丝材,而在打印中丝材频繁的屈曲或断裂常导致打印中断,需要人工干预排除故障[21,22]。另外,一般医用级可降解材料的原材料多为粒状材料。Wang等[23]采用基于螺杆挤出喷头的精密挤出沉积系统制备PCL组织工程支架,该系统可以用于粒状、粉末状材料成型,提高成型自由度。但是,上述打印系统仍采用层层堆积的方法成型,在悬空处不可避免需要打印支撑结构,但对于血管支架之类的单层空间异形网状结构、小特征尺寸结构,采用一般方法进行打印,需产生大量的支撑结构,严重影响打印精度与效率。此外,值得注意的是,聚合物材料的分子量随着在螺杆挤出喷头中的滞留时间的增加而减小,因此小型化挤出喷头更利于生物聚合物材料的熔融挤出[24]。
综合以上需求,本研究采用一种基于微螺杆挤出的3D打印系统,并通过增加旋转轴(第四轴)实现四轴联动打印。如图3所示,该系统主要包括三个部分:①x-y-z 运动系统;②旋转轴;③微型螺杆挤出喷头。 x-y-z 运动系统采用龙门架结构,使用松下交变伺服电机驱动。旋转轴形状和长度可以根据支架制备需求灵活调整。为保证打印精度,x-y-z 运动系统的移动、旋转轴的转动以及微螺杆喷头的转动通过美国欧姆龙公司的可编程多轴控制器集成控制。
微螺杆喷头是成型系统的关键部件,其结构和主要部件如图3(c)所示。加热元件连接到料筒外表面,为材料提供热量。因此,当微螺杆喷头工作时,可以将粒状或粉末状材料通过进料口添加到料筒中,电机传动带动螺杆将材料向下输送,螺杆和料筒间的腔室充满了熔融材料。最后,腔室内产生的压力有助于熔融材料通过喷嘴尖端挤出成细丝。
 图3.自制基于螺杆挤出的3D打印系统。(a)支架制备流程图;(b)3D打印系统原理图;(c)微螺杆挤出喷头结构图。
图3.自制基于螺杆挤出的3D打印系统。(a)支架制备流程图;(b)3D打印系统原理图;(c)微螺杆挤出喷头结构图。
© Engineering
3.2. 打印参数研究
为确定制造3D打印PCL支架的适合温度,使用上述自制微螺杆挤出喷头研究了不同温度下的PCL(美国 Sigma-Aldrich公司,货号:MSDS 440744)成丝性能。鉴于支架丝宽度多为100~400 μm,喷头喷嘴直径(Φnozzle)选为250 μm。使用差示扫描量热(differential scanning calorimetry, DSC)设备DSC Q2000(意大利TA公司),在温度为–80~200 ℃、加热速度为10 ℃· min–1 、氮气氛围下,对PCL原材料进行DSC分析,测量其玻璃化转变温度、熔点(Tm)以及热分解温度。使用WDW 3020万能力学试验机(中国长春科新测试仪器公司),在50 N 负载、1 mm· min–1 拉伸速度下,对PCL进行单丝拉伸实验。
如图4(a)所示,DSC结果表明,PCL原材料具有较低的熔化温度60 ℃以及较宽的加工温度区间。一般,为保证材料的充分熔化,喷头加热温度(Textruder)设为略高于材料熔点。如图4(b)所示,分别在75~85 ℃之间的5个温度(75 ℃、77.5 ℃、80 ℃、82.5 ℃和85 ℃)下制备PCL单丝,螺杆转速设为11.2 r· min–1 。五组样品的PCL丝径(Φfilament)分别为(319.33±5.65) μm、 (318.03±6.69) μm、(311.14±2.21) μm、(312.18±3.19) μm 和 (315.10±9.48) μm,拉伸强度分别为(16.97±0.80) MPa、 (15.53±1.73) MPa、(16.22±0.56) MPa、(15.04±0.96) MPa 和(14.87±1.55) MPa。
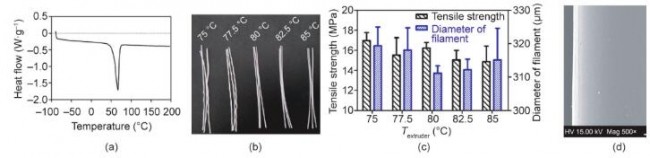 图4.研究加热温度对PCL挤出的影响。(a)PCL材料DSC曲线;(b)加热温度对PCL单丝直径和拉伸强度的影响;(c)80 ℃下制备 PCL单丝SEM图(荷兰FEI Quanta 200设备)。(c)中的数据以平均值±误差方式表示。
图4.研究加热温度对PCL挤出的影响。(a)PCL材料DSC曲线;(b)加热温度对PCL单丝直径和拉伸强度的影响;(c)80 ℃下制备 PCL单丝SEM图(荷兰FEI Quanta 200设备)。(c)中的数据以平均值±误差方式表示。
© Engineering
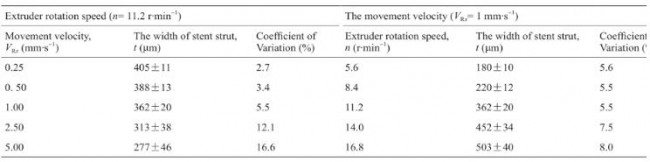
为确定合适的x-y-z 运动系统的移动速度、旋转轴的转动速度(nm,单位:r·min–1 )以及微螺杆喷头的转动速度(n,单位:r· min–1 ),将三者联动进行初步打印。如图3和图4所示,在支架打印过程中,仅需旋转轴和x轴(沿着旋转轴的轴向方向)配合工作。因此,可以将支架打印时的运动简化成包含VR和Vx的二维运动,VR(单位:mm· s–1 ,nm = VR×60/πD,D表示支架内径)为旋转轴的线速度,Vx为x轴的直线运动速度。由图1可知,θ =60°,因此,Vx = 图片VR。我们不妨将二者合并为平台移动速度VRx ,则 VRx= 图片(单位:mm· s–1 )。本文中,支架丝宽(t)取决于螺杆喷头转速(n)。
如表1所示,当螺杆喷头转速设为11.2 r· min–1 ,在不同平台移动速度VRx(0.25 mm· s–1 、0.50 mm· s–1 、1.00 mm· s–1 、 2.50 mm· s–1 和5.00 mm· s–1 )下打印支架,支架丝宽t为 (405±11) μm、(388±13) μm、(362±20) μm、(313±38) μm 和(277±46) μm;当平台移动速度设为1 mm· s–1 ,在不同螺杆喷头转速n(5.6 r· min–1 、8.4 r· min–1 、11.2 r· min–1 、 14 r· min–1 和16.8 r· min–1 )下打印支架,支架丝宽t为 (180±10) μm、(220±12) μm、(362±20) μm、(452±34) μm 和(503±40) μm。
表1 不同平台运动速度和挤出喷头螺杆旋转速度下的支架丝宽
4.1. 支架制备
Liu等[25]提出,在熔融挤出过程中,在某一点喷头停止工作时,喷头内残余的压力仍会将材料从喷头内挤出,此现象称之为“流涎”。“流涎”现象会导致支架结构的缺陷,因此,支架制备过程中的打印路径规划尤为重要。若通过打印路径规划避免喷头的重复起停,则材料流涎可以随之消除。
因此,基于图1中的支架设计,通过引入辅助线[图 5(a)中的灰色线],规划了连续的支架打印轨迹,其中箭头方向表示打印过程中喷头移动方向。在此打印策略中,第一层,熔融的PCL丝沉积形成沿圆周方向的Z 形线(红色线),相邻的Z形线在其终点通过“桥”线(黑色短线)连接;第二层,长度为H的直线(黑色长线)沿轴向平行打印,相邻直线通过辅助线(灰色线)连接。由于挤出后的余热,在Z形线和黑色长直线的交接点,材料熔合在一起。在本文中,上述成型方法称为“重合打印法”。
基于微螺杆挤出喷头的3D打印系统被用于支架的制备,熔融材料通过喷嘴挤出后沉积在旋转轴表面,随着x-y-z运动系统与旋转轴的联动,细丝沿周向和环向交替打印形成支架结构[图5(b)]。通过改变旋转轴的直径和形状以及支架模型的几何结构,实现支架的定制式制备。基于四轴联动与熔融挤出,制备了具有不同材料、不同形状、不同结构的3D打印支架[图5(c)~(e)]。
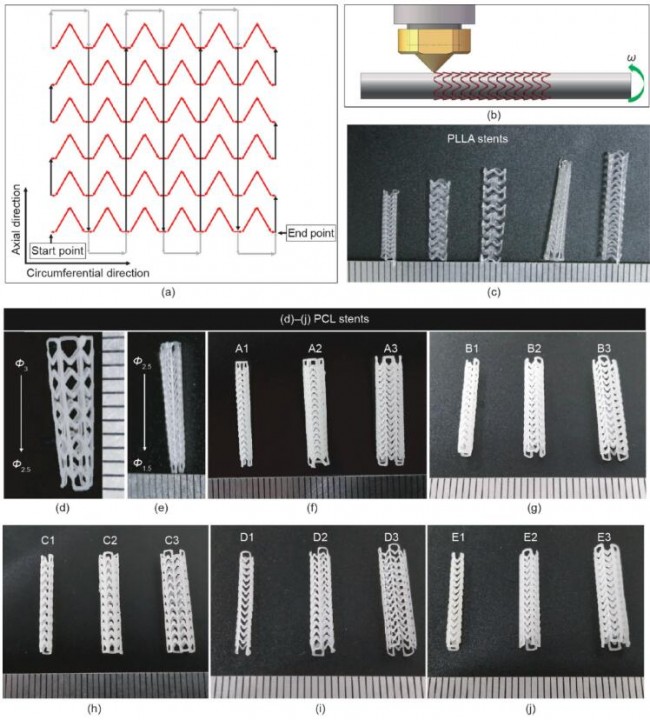 图5. 3D打印心血管支架。(a)支架打印路径;(b)支架打印原理图,ω:角速度;(c)不同结构的PLLA支架;(d)~(e)锥形PCL支架;(f)~(j)表2中支架(A1~E3)的图像。Ф:支架直径。
图5. 3D打印心血管支架。(a)支架打印路径;(b)支架打印原理图,ω:角速度;(c)不同结构的PLLA支架;(d)~(e)锥形PCL支架;(f)~(j)表2中支架(A1~E3)的图像。Ф:支架直径。
© Engineering
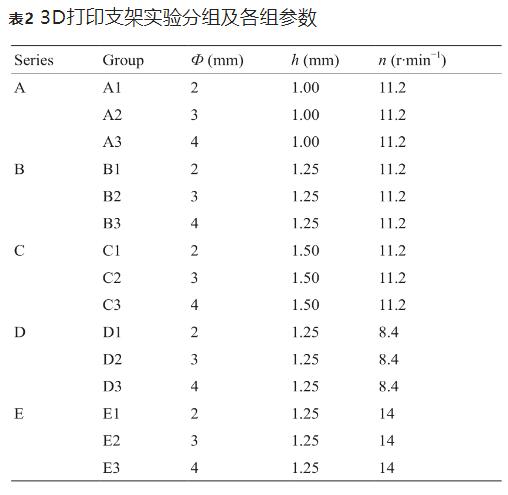
如表2所示,本研究对比了不同直径D、不同支架设计(其中一个主要指标:连接杆长度h)以及不同成型参数(其中一个主要指标:螺杆喷头转速n)下的支架,五组支架分别制备如图5(f)~(j)所示。各组支架中,图片、θ和H固定。由图1可知,πD = 图片, H = N2h。本文中,我们设图片 = 1.5 mm,图片 = π/4−0.75,θ = 60°,以及H = 15 mm。因此,当Ф = 2 mm、3 mm或 4 mm时,N1分别为4、6或8;当h = 1.00 mm、1.25 mm 或1.50 mm时,N1分别为15、12或10。
对上述成型PCL支架,进行扫描电子显微镜观察,如图6所示,可见支架表面光滑,无明显缺陷,具有良好的表面形态;采用“重合打印法”打印的支架在细丝交叉点熔合良好,可保证支架在交接点具有较好的连续性和结合强度。
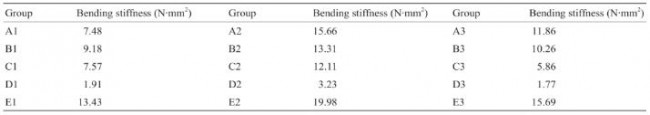
如图7所示,通过Keyence光学显微镜(VHX-500,日本)观察支架表面形态,并对支架支撑杆宽度进行测量,对比不同成型组别间支架支撑杆宽度差异。组E (E1~E3)、组A~C(A1~C3)、组D(D1~D3)的支架丝宽分别为(220±12) μm、(362±42) μm和(452±35) μm。在表2中,螺杆转速关系为D < A = B = C < E,支架的支撑杆宽度主要与螺杆转速相关,这与支撑杆宽度大小关系是一致的。但是在A、B、C三组间,C组支架宽度 [(404±38) μm]要略高于A [(349±28) μm]、B [(334±23) μm] 二组。

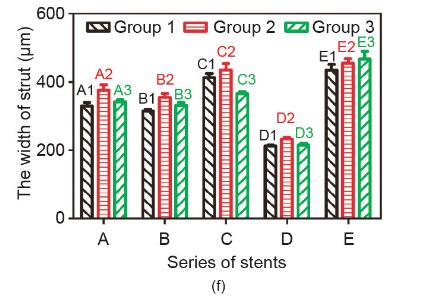 图7.A~E组支架丝宽。(a)~(e)支架光学显微镜图片;(f)不同组支架丝宽对比。(f)中的数据以平均值±误差方式表示。
图7.A~E组支架丝宽。(a)~(e)支架光学显微镜图片;(f)不同组支架丝宽对比。(f)中的数据以平均值±误差方式表示。
© Engineering
4.3. 支架机械性能
三点弯曲测试和径向压缩测试是支架力学性能测试的主要方法。三点弯曲试验是检测支架的弯曲性能(柔顺性),径向压缩试验用来检测支架的径向强度。依据美国材料与试验协会有关标准ASTM F2606-08和ASTMF3067-14 [26,27],采用图8(a)~(b)所示INSTRON 3365测试机(美国),对表2中的五组支架进行了三点弯曲和径向压缩测试。此外,通过扩张式球囊装置对C1、 C2组支架展开了径向扩张测试[图8(c)]。
 图8.支架力学性能测试。(a)三点弯曲测试;(b)径向压缩测试;(c)径向扩张测试。
图8.支架力学性能测试。(a)三点弯曲测试;(b)径向压缩测试;(c)径向扩张测试。
© Engineering
4.3.1. 三点弯曲测试
三点弯曲试验用来检测支架的弯曲性能(柔顺性),柔顺性好的支架在支架介入治疗过程中能够更容易通过动脉弯曲部分。支架柔顺性大小用弯曲刚度来表示:弯曲刚度越大,支架柔顺性越小。弯曲刚度通过E· I 计算,具体表示为[26,28]:
式中,F为外弯曲力;L为支架跨度;f为支架弯曲挠度。本实验中,L为11 mm,因此,当变形f设为固定值,对应更小外力F的支架具有更好的支架柔顺性。当变形f 为2 mm时,A、B、C三组支架对应的外力F如图9(d)所示;B、D、E三组支架对应的外力F如图9(h)所示。
由图9(a)~(d)可知,A、B、C三组柔顺性关系为B1 < A1 ≈ C1、A2 < B2 < C2和A3<B3<C3;随着连接杆长度从1.00 mm增加到1.50 mm,对Ф2、Ф3和Ф4支架,各组间的C组与A组支架(C1/A1, C2/A2, C3/A3)外力F之比分别为1.01、0.77、0.49。由图9(e)~(h)可知,B、D、E三组柔顺性关系为E1 < B1 < D1、E2 < B2 < D2、E3 < B3 < D3。
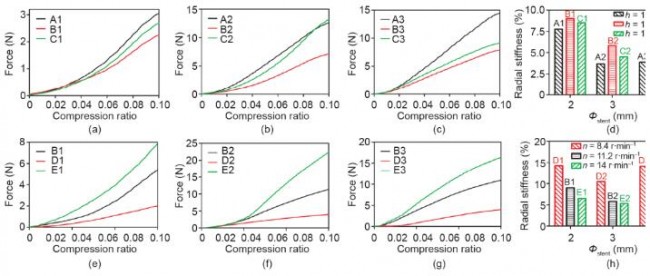 图9.不同结构和制造参数的3D打印PCL支架的三点弯曲测试结果。(a)~(c)支架连接杆长度分别为1 mm、1.25 mm和1.5 mm时(对应A、B、C三组),各组支架外力F与支架变形曲线图;(d)当支架变形为2 mm时,各组支架对应的外力F大小;(e)~(g)螺杆喷头转速为8.4 r·min−1 、11.2 r·min−1 和14 r·min−1 (对应D、B、E三组)时,各组支架外力F与支架变形曲线图;(h)当支架变形为2 mm时,各组支架对应的外力F大小。图(d)和(h)中的数据以平均值±误差方式表示。
图9.不同结构和制造参数的3D打印PCL支架的三点弯曲测试结果。(a)~(c)支架连接杆长度分别为1 mm、1.25 mm和1.5 mm时(对应A、B、C三组),各组支架外力F与支架变形曲线图;(d)当支架变形为2 mm时,各组支架对应的外力F大小;(e)~(g)螺杆喷头转速为8.4 r·min−1 、11.2 r·min−1 和14 r·min−1 (对应D、B、E三组)时,各组支架外力F与支架变形曲线图;(h)当支架变形为2 mm时,各组支架对应的外力F大小。图(d)和(h)中的数据以平均值±误差方式表示。
© Engineering
表3所示为变形f为2 mm时,各组支架的弯曲刚度值(平均值)。据报道[29],此前商业化的Absorb GT1 支架弯曲刚度值为4.20 N· mm2 ,这与A1、C1、C3、 D1~D3等几组支架弯曲刚度值接近。因此,A1、C1、 C3、D1~D3支架具有相对合适的弯曲柔顺性。
4.3.2. 径向压缩测试
径向压缩试验用于评估径向强度,从而确定支架的径向支撑力。具有良好径向强度的支架可以提供更好的支撑。径向强度可以用径向刚度表示:径向刚度越大,径向强度越小。Schmidt等[30]提出将支架径向刚度定义为支架直径从外压0到外压0.2 bar (1 bar = 105 Pa)时的变化程度[式(16)]。ASTM标准F3067-14 [27]建议使用瞬时支架直径来计算支架压缩比,而非仅适用初始直径[式(17)、(18)]。因此,径向刚度是当作用在支架上的瞬时压力为0.2 bar时的压缩比。
支架径向强度主要与支撑杆宽度t以及Z形环数目有关。由图10(a)~(d)可知,A、B、C三组支架径向刚度关系为Bi>Ci>Ai(i = 1, 2, 3),因此三组支架径向强度关系为Bi<Ci<Ai(i = 1, 2, 3);由图10(e)~(h)可知,B、D、E三组支架径向刚度关系为Di>Bi>Ei(i = 1, 2, 3),因此三组支架径向强度关系为Di<Bi<Ei (i = 1, 2, 3)。
据报道[30],商业化支架径向刚度从0.51%到 3.99%,这与A2、A3、C2、C3、E3支架相近。因此, A2、A3、C2、C3、E3支架具有相对合适的径向强度。
 图10.不同结构和制造参数的3D打印PCL支架的径向弯曲测试结果。(a)~(c)支架连接杆长度分别为1 mm、1.25 mm和1.5 mm(对应A、B、C三组)时,各组支架外力F与支架压缩比曲线图;(d)(a)~(c)中各组支架径向刚度大小;(e)~(g)螺杆喷头转速为8.4 r·min−1 、11.2 r·min−1 和14 r·min−1 (对应D、B、E三组)时,各组支架外力F与支架压缩比曲线图;(h)(e)~(g)中各组支架径向刚度大小。(d)和(h)中的数据以平均值±误差表示。
图10.不同结构和制造参数的3D打印PCL支架的径向弯曲测试结果。(a)~(c)支架连接杆长度分别为1 mm、1.25 mm和1.5 mm(对应A、B、C三组)时,各组支架外力F与支架压缩比曲线图;(d)(a)~(c)中各组支架径向刚度大小;(e)~(g)螺杆喷头转速为8.4 r·min−1 、11.2 r·min−1 和14 r·min−1 (对应D、B、E三组)时,各组支架外力F与支架压缩比曲线图;(h)(e)~(g)中各组支架径向刚度大小。(d)和(h)中的数据以平均值±误差表示。
© Engineering
4.3.3. 径向扩张测试
径向扩张测试中,C1、C2组支架均分别膨胀至扩张比为10%、20%。即C1组支架由直径2 mm分别扩张至2.2 mm、2.4 mm,C2组支架由直径3 mm分别扩张至 3.3 mm、3.6 mm,分别测量支架长度;随后,去除扩张力,观察支架径向回弹,并记录支架此时的长度。支架初始直径OФ、扩张最大直径MФ以及回弹后直径RФ如图 11(a)所示。支架直径回缩比计算如下:
C1支架在扩张至110%和120%时,支架直径回弹分别为69%和41%;C2支架在扩张至110%和120%时,支架直径回弹分别为77%和71%。3D打印PCL支架的径向回缩程度较大,这与PCL支架良好的弹性有关。为解决此问题,未来的研究将探索其他生物材料。
支架初始长度OL、扩张最大长度ML以及回弹后长度RL如图11(b)所示。支架轴向回缩比计算如下:

C1支架在扩张至110%和120%时,支架径向回弹分别为0.33%和0.13%;C2支架在扩张至110%和120%时,支架直径回弹分别为0.40%和0.09%。作为对比,目前商业化支架轴向回缩在3%~5% [31]。因此,可以确定本研究中所使用的支架设计具有相对稳定可靠的轴向长度稳定性。
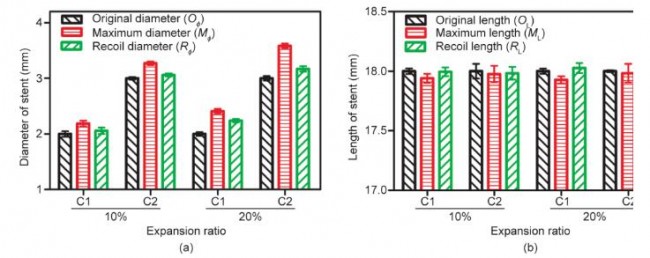 图11. 径向扩张结果。(a)支架直径变化;(b)支架长度变化。所有数据以平均值±误差表示。
图11. 径向扩张结果。(a)支架直径变化;(b)支架长度变化。所有数据以平均值±误差表示。
© Engineering
4.4. 支架生物相容性
3D打印PCL支架溶血分析实验按照ASTM标准 F756-17开展[32],新鲜人血由北京华信医院/清华大学第一附属医院合法提供。如前报道[33],样品溶血率通过测量血红蛋白释放量来确定,可表示为:
式中,ODt代表实验组吸光度;ODp和ODn分别表示阳性组和阴性组吸光度值。根据ASTM标准F756-17[32],材料溶血率可分级为非溶血(0~2%)、轻微溶血(2%~5%)、溶血(>5%)。3D打印PCL支架溶血率为 0.07% ± 0.02%(非溶血)。
3D打印PCL支架细胞相容性实验按照ISO标准 10993–5:2009开展[34],使用EGM-2 (endothelial cell growth medium-2)培养基(瑞士Lonza公司,货号 cc3162)培养人脐静脉内皮细胞(HUVECs,美国 ATCC细胞库),将支架在37 ℃培养基中孵育24 h提取材料浸提液。将HUVECs在37℃、5% CO2、浸泡支架 24 h后的EGM-2培养基中培养96 h后,加入CCK-8(cell counting kit-8,日本Dojindo公司)孵育4 h后,使用酶标仪测量细胞活性,计算公式为:
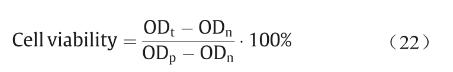
式中,ODt代表实验组吸光度;ODp和ODn分别表示阳性组和阴性组吸光度值。根据细胞活性值,材料的细胞毒性可分为0级(≥ 100%)、1级(80%~99%)、2级(50%~79%)、3级(30%~49%)和4级(0~29%)。当材料细胞毒性大于2级时,认为其具有细胞毒性。3D打印 PCL支架细胞活性为90% ± 5%(1级),因此,可以用于细胞实验。
综上,3D打印PCL支架具有良好的生物相容性。
5.1. 成型参数对打印能力与结构成型的影响
5.1.1. 喷头加热温度
支架制备前,通过PCL单丝挤出试验研究了螺杆挤出喷头加热温度对PCL丝尺寸稳定性和强度的影响,研究得知在80 ℃和82.5 ℃时PCL丝具有更好的尺寸稳定性[图4(c)],在75 ℃和80 ℃显示更好的拉伸强度。因此,综合考虑到材料成型强度和尺寸稳定性,将螺杆挤出喷头加热温度设定为80 ℃用于支架制备。如图4 (b)、(d)所示,在80 ℃下挤出的PCL丝具有良好的表面形貌。
5.1.2. x-y-z 运动速度、旋转轴转动速度
如表1所示,可通过调节平台移动速度VRx和螺杆喷头转速n改变支架丝宽(支撑杆宽度)。随VRx增加,支架丝宽减小且打印稳定性下降(误差系数增大);随螺杆喷头转速n增加,支架丝宽增大而打印稳定性提升(误差系数减小)。因此,综合考虑打印稳定性(如误差系数小于10%)与打印效率,将VRx设为1 mm· s−1 ,丝宽通过改变螺杆转速n调节。相应地,x轴移动速度Vx为 图片 mm· s−1 (0.866 mm· s−1 ),旋转轴转动线速度VR为 0.5 mm· s−1 (旋转轴转速可通过nm = VR×60/πФ计算,nm = 30/πФ,单位:r·min−1 ,Ф为支架直径)。
5.1.3. 螺杆挤出速度
在制备不同参数组支架时,螺杆喷头转速n分别设为8.4 r· min−1 (D组)、11.2 r· min−1 (A、B、C 组)、14 r· min−1 (E组)。如图7所示,支架丝宽t与螺杆转速n呈正相关:随螺杆转速增加,支架丝宽增大(D<A=B=C<E)。A、B、C三组支架采用相同转速制备,但是,与A、B组支架相比,C组支架具有相对较大的支架丝宽。因此,在未来的研究中需要进一步提高支架制造的稳定性。
5.2. 结构参数对 3D 打印 PCL 支架机械性能影响
之前已有研究使用了各种方法检测支架的机械性能,弯曲柔顺性和径向强度是支架机械性能的两个重要指标,与支架的几何参数密切相关[14,28]。基于4.3.1节和4.3.2节的讨论可知,弯曲柔顺性可用弯曲刚度表示,较高的弯曲刚度表明支架较低的柔韧性;径向强度可用径向刚度表示,较高的径向刚度表明较低的径向强度。在本研究中,影响支架机械性能的主要参数是连接杆的长度h和支架丝宽t。
5.2.1. 连接杆长度
A、B、C三组支架对应连接杆长度h分别为1 mm、 1.25 mm和1.5 mm,而支架长度固定(18 mm),因此随着连接杆长度h增加,支架具有更少的Z形环,支架弯曲性能随之增加而径向强度下降。因此,理想的支架弯曲性能和径向强度结果应为:Ai<Bi<Ci、Ci<Bi<Ai (i =1, 2, 3)。
由图9(a)~(d)和表3可知,A、B、C三组弯曲性能对比为:B1<A1≈C1、A2<B2<C2、A3<B3<C3。总体而言,随着连接杆长度h增加,支架弯曲性能提高,在支架直径较大时表现更加明显。由图10(a)~(d)可知,A、B、C三组支架径向强度:Bi<Ci<Ai (i =1, 2, 3),这与理想结果有所偏差,在5.2.2节中会进一步解释此现象。
总之,具有更长连接杆的支架在柔顺性上具有优势。但是,在这一部分并不确定长连接杆(在支架丝宽略微存在区别的情况下)是否严格不利于径向强度。
5.2.2. 支架丝宽
D、B、E三组支架对应螺杆喷头转速t分别为 8.4 r·min−1 、11.2 r·min−1 、14 r·min−1 ,支架丝宽与螺杆转速正相关,随着转速增加,支架丝宽增大,随之导致更大的径向强度和更低的弯曲柔顺性。因此,D、B、E三组支架对比的理想结果为:柔顺性Ei<Bi<Di,径向强度 Di<Bi<Ei(i = 1, 2, 3)。
由图7、图9、图10可知,实际测试结果与上述理想结果一致,因此,可得支架丝宽是支架径向强度的主要因素。此外,5.2.1节中提到,A、B、C三组支架径向强度Bi<Ci<Ai (i =1, 2, 3),这与理想结果Ci<Bi<Ai 不一致。该结果可以通过支架丝宽解释:从图7(f)可以确定,尽管C组支架具有更少的Z形环,但由于其丝宽更大,与B组相比,其径向强度更大。这进一步证明了支架丝宽是决定支架径向强度的主导因素。
5.2.3. 小结
根据5.2.1节和第5.2.2节的讨论,可以看出支架柔顺性和径向强度是一对相互矛盾的性能。这是为实现支架综合机械性能而需权衡支架结构参数的结果。对于相同直径的支架,支架的机械性能(弯曲柔顺性和径向强度)与连接杆长度和支架丝宽密切相关。
支架弯曲柔顺性。综上可知,具有较长连接杆和较小丝宽的相同直径支架倾向于具有更好的弯曲柔顺性。因此,具有松散几何结构的支架倾向于表现出更好的柔顺性。
径向强度。结合上述讨论,可以推断出支架丝宽(t)是影响支架径向强度的主要因素,这可以结合式(12)得到验证。式(12)表明支架的结构强度与t3 成正比,与h成反比。这意味着支架的径向强度更易受到t的影响。可以推断,具有较大连接杆(h)和适中支架丝宽的支架更有利于在柔顺性与径向强度之间取得平衡。
本研究中,研究人员开发了一种新型基于微螺杆挤出式 3D打印系统,通过增加第四轴旋转轴制造支架。研究提出了一种新型ZPR结构心血管支架,并证明了支架扩张后可保持轴向长度稳定。通过单丝实验初步研究了适合支架制备的成型参数,随后采用“重合打印法”制备具有不同材料(PLLA、PCL)、形状、几何结构的支架,进一步研究了不同参数成型PCL支架的机械性能。
综上,本文提出的基于微螺杆挤出的3D打印系统显示出个性化制备支架的潜力。然而,PCL支架柔顺性的不足表明在未来的研究中需进一步改进支架设计。此外,与金属支架相比,PCL支架在径向强度和径向回弹方面并不理想,之后还需探索制备PLLA或具有更高强度和更低伸长率的可降解聚合物支架。
参考文献
[1] Stettler C, Wandel S, Allemann S, Kastrati A, Morice MC, Schömig A, et al. Outcomes associated with drug-eluting and bare-metal stents: a collaborative network meta-analysis. Lancet 2007;370:937–48.
[2] Zhang Y, Bourantas CV, Farooq V, Muramatsu T, Diletti R, Onuma Y, et al. Bioresorbable scaffolds in the treatment of coronary artery disease. Med Devices Evid Res 2013;6:37–48.
[3] Wiebe J, Nef HM, Hamm CW. Current status of bioresorbable scaffolds in the treatment of coronary artery disease. J Am Coll Cardiol 2014;64:2541–51.
[4] Ang HY, Bulluck H, Wong P, Venkatraman SS, Huang Y, Foin N. Bioresorbable stents: current and upcoming bioresorbable technologies. Int J Cardiol 2017;228:931–9.
[5] Joner M, Finn AV, Farb A, Mont EK, Kolodgie FD, Ladich E, et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk. J Am Coll Cardiol 2006;48:193–202.
[6] Onuma Y, Ormiston J, Serruys PW. Bioresorbable scaffold technologies. Circ J 2011;75:509–20.
[7] Iqbal J, Onuma Y, Ormiston J, Abizaid A, Waksman R, Serruys P. Bioresorbable scaffolds: rationale, current status, challenges, and future. Eur Heart J 2014;35:765–76.
[8] Stepak B, Anton´ czak AJ, Bartkowiak-Jowsa M, Filipiak J, Pezowicz C, Abramski KM. Fabrication of a polymer-based biodegradable stent using a CO2 laser. Arch Civ Mech Eng 2014;14:317–26.
[9] Guerra AJ, Farjas J, Ciurana J. Fibre laser cutting of polycaprolactone sheet for stents manufacturing: a feasibility study. Opt Laser Technol 2017;95:113–23.
[10] Guerra AJ, Ciurana J. 3D-printed bioabsordable polycaprolactone stent: the effect of process parameters on its physical features. Mater Des 2018;137:430–7.
[11] Martinez AW, Chaikof EL. Microfabrication and nanotechnology in stent design. WIREs Nanomed Nanobiotechnol 2011;3:256–68.
[12] Kaesemeyer WH, Sprankle KG, Kremsky JN, Lau W, Helmus MN, Ghatnekar GS. Bioresorbable polystatin fourth-generation stents. Coron Artery Dis 2013;24:516–21.
[13] Park SA, Lee SJ, Lim KS, Bae IH, Lee JH, Kim WD, et al. In vivo evaluation and characterization of a bio-absorbable drug-coated stent fabricated using a 3Dprinting system. Mater Lett 2015;141:355–8.
[14] Wu Z, Zhao J, Wu W, Wang P, Wang B, Li G, et al. Radial compressive property and the proof-of-concept study for realizing self-expansion of 3D printing polylactic acid vascular stents with negative poisson’s ratio structure. Materials 2018;11(8):1357.
[15] Wang WQ, Liang DK, Yang DZ, Qi M. Analysis of the transient expansion behavior and design optimization of coronary stents by finite element method. J Biomech 2006;39:21–32.
[16] Stoeckel D, Bonsignore C, Duda S. A survey of stent designs. Minim Invasive Ther Allied Technol 2002;11:137–47.
[17] Attard D, Grima JN. Modelling of hexagonal honeycombs exhibiting zero Poisson’s ratio. Phys Status Solidi Basic Res 2011;248:52–9.
[18] Masters IG, Evans KE. Models for the elastic deformation of honeycombs. Compos Struct 1996;35:403–22.
[19] Young WC, Budynas RG. Roark’s formulas for stress and strain. 7th ed. Beijing: Tsinghua University Press; 2003. Chinese.
[20] Grima JN, Oliveri L, Attard D, Ellul B, Gatt R, Cicala G, et al. Hexagonal honeycombs with zero Poisson’s ratios and enhanced stiffness. Adv Eng Mater 2010;12:855–62.
[21] Venkataraman N, Rangarajan S, Matthewson MJ, Harper B, Safari A, Danforth SC, et al. Feedstock material property—process relationships in fused deposition of ceramics (FDC). Rapid Prototyp J 2000;6:244–52.
[22] Liu B, Xie Y, Wu M. Research on the micro-extrusion characteristic of mini-screw in the screw extruding spray head. Polym Bull 2010;64: 727–38.
[23] Wang F, Shor L, Darling A, Khalil S, Sun W, Güçeri S, et al. Precision extruding deposition and characterization of cellular poly-e-caprolactone tissue scaffolds. Rapid Prototyp J 2004;10:42–9.
[24] Capone C, Di Landro L, Inzoli F, Penco M, Sartore L. Thermal and mechanical degradation during polymer extrusion processing. Polym Eng Sci 2007;47:1813–9.
[25] Liu C, Li Y, Zhang L, Mi S, Xu Y, Sun W. Development of a novel lowtemperature deposition machine using screw extrusion to fabricate poly(Llactide-co-glycolide) acid scaffolds. Proc Inst Mech Eng Part H J Eng Med 2014;228:593–606.
[26] F2606-08 Standard guide for three-point bending of balloon expandable vascular stents and stent systems. US Standard. West Conshohocken: American Society of Testing Materials; 2014.
[27] F3067-14 Guide for radial loading of balloon expandable and self expanding vascular stents. US Standard. West Conshohocken: American Society of Testing Materials; 2014.
[28] Wang Q, Fang G, Zhao Y, Wang G, Cai T. Computational and experimental investigation into mechanical performances of poly-L-lactide acid (PLLA) coronary stents. J Mech Behav Biomed Mater 2017;65:415–27.
[29] Schmidt W, Behrens P, Brandt-Wunderlich C, Siewert S, Grabow N, Schmitz KP. In vitro performance investigation of bioresorbable scaffolds—standard tests for vascular stents and beyond. Cardiovasc Revascularization Med 2016;17:375–83.
[30] Schmidt W, Lanzer P, Behrens P, Topoleski LDT, Schmitz KP. A comparison of the mechanical performance characteristics of seven drug-eluting stent systems. Catheter Cardiovasc Interv 2009;73:350–60.
[31] Colombo A, Stankovic G, Moses JW. Selection of coronary stents. J Am Coll Cardiol 2002;40:1021–33.
[32] F756-17 Standard practice for assessment of hemolytic properties of materials. US Standard. West Conshohocken: American Society of Testing Materials; 2017.
[33] Im SH, Kim CY, Jung Y, Jang Y, Kim SH. Biodegradable vascular stents with high tensile and compressive strength: a novel strategy for applying monofilaments via solid-state drawing and shaped-annealing processes. Biomater Sci 2017;5:422–31.
[34] ISO 10993-5:2009 Biological evaluation of medical devices—part 5: tests for in vitro cytotoxicity. EN Standard. Geneva: International Organization for Standardization; 2009.
l 谷专栏 l
欢迎高校及科研机构、企业科学家加入谷专栏,与业界分享对推动增材制造发展起关键作用的共性基础科研与应用成果,欢迎扫描下方图片二维码提交您的信息。
白皮书下载 l 加入3D科学谷QQ群:106477771
网站投稿 l 发送至2509957133@qq.com
欢迎转载 l 转载请注明来源3D科学谷 l 链接到3D科学谷网站原文。