根据中国工程院院刊Engineering,目前市场上大多数全膝关节置换(TKR)假体是根据高加索人的体型设计的。大量研究表明,不同种族之间的人体解剖结构不同,中国的TKR患者与现有进口假体并不匹配。论文《基于中国族群的个性化增材制造全膝关节置换假体设计》研究测量了52名中国男性和女性的膝关节计算机断层扫描(CT)图像。通过定义参数和几何尺寸,进行相关性分析。从测量结果中识别出关键参数。测量膝关节详细几何形状的坐标数据。基于与所标识的关键参数相关的解剖坐标系统,生成了可变形的三维(3D)膝关节模型。然后根据分析结果设计假体,进行表面匹配分析、切骨分析和尸体试验,并将其与商业假体产品进行比较以验证我们的设计。论文研究设计的股骨组件与两种商业器械相比,具有更高的准确性[均方根比(RMS PS)为(1.08 ± 0.20) mm],而切除的骨量最低(27 412 mm3)。这项研究为基于族群的患者特定的股骨假体设计提出了一种新方法。使用一个易于获取的尺寸[即上髁宽度(ECW)]作为输入,可以根据分析的测量数据设计特定患者的股骨假体,并通过增材制造(AM)方法进行制造。同时,在原始CT扫描数据中将重建的股骨表面与原股骨表面进行比较。在所有数据中,重建的股骨表面的平均RMS PS距离为(1.10 ± 0.18)mm,这与使用多个X射线照片作为输入数据的其他统计形状建模方法相当。
本期谷.专栏将对这一研究成果的核心内容进行分享。
目前市场上对基于中国族群人体测量的膝关节假体有很大需求。论文研究基于中国族群人体测量学,设计出更适合中国患者的膝关节假体,并保留了更多的骨量,这是迈向个性化膝关节假体增材制造的重要一步。
本研究得到了山东威高骨科医疗器械有限公司的产学研合作课题经费支持(该公司未参与数据分析)。
https://www.engineering.org.cn/ch/10.1016/j.eng.2020.02.017
1.1. 背景
广泛的研究表明,不同种族之间的人体解剖学有所不同。据Yue等[1]研究发现,中国膝关节尺寸通常小于白种人。此外,中国女性的股骨远端比白人女性窄,而中国男性的胫骨近端比白人宽。Ho等[2]研究发现,与西方人相比,亚洲人总体上的身材和体型较小。文献 [1–3]研究比较了亚洲人和高加索人的膝部几何形状,发现他们的股骨的长宽比(中外侧长度/前后长度)不同。由于缺乏适合中国族群测量学特征的假体,一些中国患者的全膝关节置换(TKR)假体与市售的假体不匹配。假体过小会导致假体下陷,而组件的悬垂会导致软组织磨损,最终导致手术失败[4]。大多数市售的TKR假体都是根据高加索膝关节的人体测量数据设计的,据报道这是造成亚洲人部件失配的主要原因[1,3]。这种对高加索假体的依赖导致假体与切除的骨表面之间不匹配[5]。因此,亟需开发基于中国族群人体测量的膝关节假体。
借助增材制造(AM)技术,可以制造针对个性化患者的假体和器械。AM,也称为3D打印,是一种利用材料[6]逐层堆积生成3D部件的技术。医学3D模型越来越多地用于外科手术计划、医学计算模型、算法验证以及医学设备开发[7]。生物打印和3D打印在组织工程、再生医学和药物筛选中具有巨大的潜力[8,9]。3D打印特别适合于定制制造,如人造植入物(人造骨骼和牙齿等)以及医疗康复设备和装置的制造[10]。在整形外科领域,3D打印通常用于创建定制的内植入物和针对特定患者的器械,生物打印助力于组织,尤其是骨骼和软骨的再生[10,11,12]。患者个性化器械(PSI)可以提高手术准确性,并且优于徒手切除术[11,13]。定制金属 3D打印的患者专用植入物和器械正越来越多地用于盆腔肿瘤切除、切除缺损的重建和翻修髋关节置换的研究 [14,15]。本研究开发的个性化全膝关节置换假体,也可通过最新的3D打印技术制造,在PSI的辅助下植入患者体内,完成高精准的膝关节置换手术。
1.2. 研究目的
本研究旨在根据中国族群数据开发膝关节假体。开发的假体可以更好地适合中国人的膝关节,有助于更好地保护中国患者的骨骼。
1.3. 研究假设
通过合并维度索引数据和几何人体测量数据,可以生成基于中国族群的膝关节模型。并基于生物力学分析和制造的考虑,以及中国族群数据平均水平设计膝关节假体,以获得更好的手术效果。
1.4. 目标
本研究的目标是:
(1)制定一种标准方法来收集中国族群人体测量数据,包括膝关节的尺寸指标数据和几何数据;
(2)开发一种根据收集到的人体测量数据生成膝关节模型和假体设计的方法;
(3)分析开发的基于中国族群的TKR假体的有效性和可行性。
2.1. 受试者招募
本研究是一项基于中国族群的人体测量研究,旨在进行适合中国人的膝关节假体设计,因此有必要从医学图像中获取足够的人体下肢的数据,因为下肢的力学对准对于膝关节假体研究至关重要。选择计算机断层扫描(CT)图像进行分析是因为本研究的主要目的是研究整个下肢区域中最外层骨结构的几何形状,而众所周知CT扫描是获取感兴趣区域中骨结构数据的最佳方法。本研究使用GE LightSpeed体积计算机断层扫描(美国通用电气)进行CT扫描,切片增量为0.5 mm,切片厚度为0.625 mm,像素大小为0.8 mm,视场为400 mm。本研究使用血管造影CT图像,受试者年龄在50~70岁之间。由于研究的目的是研究正常成人膝关节的人体测量学,因此排除了患有骨关节炎、骨折畸形或其他影响人体测量学的疾病的病理病例的CT图像。
根据先前描述的膝关节解剖结构、下肢轴线和髁测量的研究[16–21],在研究人员的初步研究中,研究人员选择了与膝关节的人体测量学特征密切相关的四个关键人体测量学变量:上髁宽度、股骨外侧髁深度、股骨内侧髁深度和股骨内侧髁比率。估算共需45名受试者才能可靠地描述所有四个变量,达到标准偏差(SD)为8,显著性水平为0.05,功效为80%的目标。本研究共使用52位受试者的52个下肢(从骨盆到脚踝)的CT扫描数据。其中包括26名男性和26名女性;受试者的年龄为50~70岁(63.19±5.61)。图像的规格如图1所示。
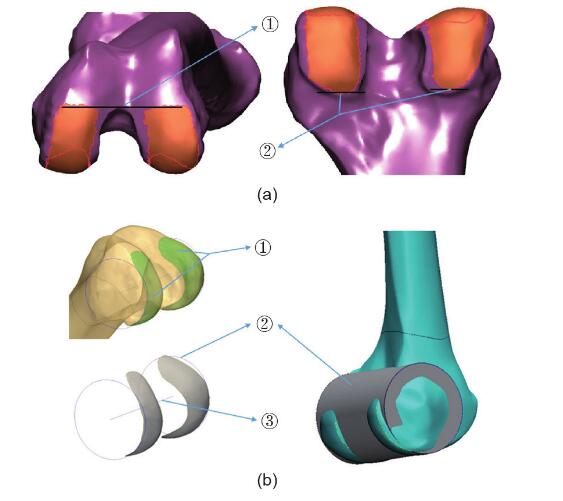 图1.(a)用于拟合髁圆柱体的标记区域的边界。①前边界:在髁上切迹弧的水平切线处;②后边界:位于后髁接触面的内侧和外侧的末端。(b)新定义的后髁轴(NPCA)的方法:①股后后髁的标记表面光滑;②髁后柱的轮廓和表面图像;③NPCA。
图1.(a)用于拟合髁圆柱体的标记区域的边界。①前边界:在髁上切迹弧的水平切线处;②后边界:位于后髁接触面的内侧和外侧的末端。(b)新定义的后髁轴(NPCA)的方法:①股后后髁的标记表面光滑;②髁后柱的轮廓和表面图像;③NPCA。
© Engineering
2.2. 人体坐标系统
由具有骨科学博士学位的生物医学工程师使用医学图像处理软件Mimics 18.0(比利时Materialise公司)对 DICOM格式的CT扫描数据进行分割和3D骨模型重建。在Mimics 18.0软件中使用对应的解剖界标上的几何拟合功能定义髋中心、膝关节中心、踝中心和后髁轴。以标准模板库(STL)格式导出股骨、胫骨和骨的3D模型,以便进一步分析处理。
2.2.1. 新定义的后髁轴
以前的膝关节人体测量学研究认为,股骨后髁的形状类似于圆柱体[16,17]。文献表明,通过拟合圆柱体的形式对后髁进行建模,可以最接近地重现后髁的几何形状[16–18,22]。为了使用Mimics 18.0软件拟合此圆柱体,必须先标记髁表面的区域。但是,不同的研究对髁表面边界的定义有所不同。因此,在本研究中,研究人员定义标记髁表面的清晰且易于复制的边界。前边界从髁切迹弧的水平切线开始,后边界终止于后髁接触面的边缘(图1)。然后安装一个圆柱体,该圆柱体的轴是新定义的后髁轴(NPCA)(图1)。以前的研究发现, NPCA比上髁轴更一致和更可靠[19]。
2.2.2. 髋关节、膝关节和脚踝中心
股骨头的接触表面被认为是一个球体。根据文献,可以通过拟合最合适的球体来计算髋关节,该球体由放置在大腿上的标记轨迹描述[20,23]。标记该接触表面的区域,不包括股骨头中央凹的区域,然后生成虚拟球体。髋关节定义为该球体的中心(图2)。膝关节中心定义为 NPCA的中点(图1)。据报道,脚踝关节表面可以看作是圆锥的一部分,其轴线位于脚踝的经验轴线上[24]。标记踝关节的胫骨远端接触区域,并拟合圆柱体。脚踝中心定义为该圆柱的中心(图3)。
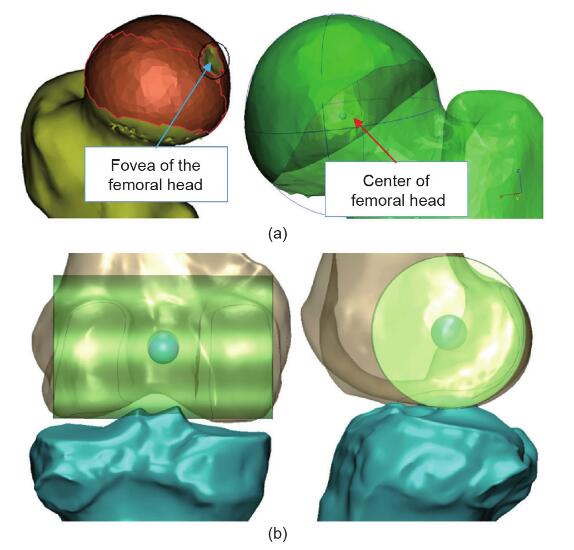 图2.(a)股骨头接触面的标记区域,其中中央凹区域被排除。用于生成一个球体并定位中心。(b)膝关节中心的图示
图2.(a)股骨头接触面的标记区域,其中中央凹区域被排除。用于生成一个球体并定位中心。(b)膝关节中心的图示
© Engineering
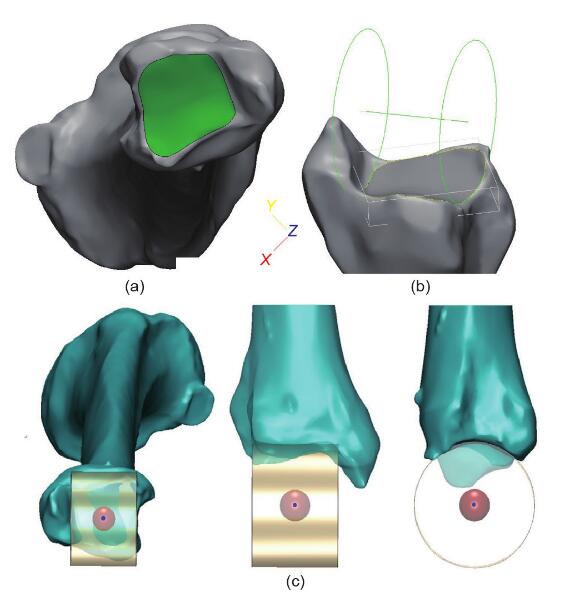 图3. 脚踝中心的示意图。(a)标记踝关节的胫骨远端接触区域;(b)根据标记表面产生的圆柱体;(c)脚踝关节的中心位置。
图3. 脚踝中心的示意图。(a)标记踝关节的胫骨远端接触区域;(b)根据标记表面产生的圆柱体;(c)脚踝关节的中心位置。
© Engineering
2.2.3. 定义人体测量坐标系
将3D模型的STL文件导入计算机辅助设计软件 SolidWorks(美国达索系统)中,以构建3D坐标系(图 4),以方便标准化和可重复地测量股骨、胫骨和髌骨的几何参数。
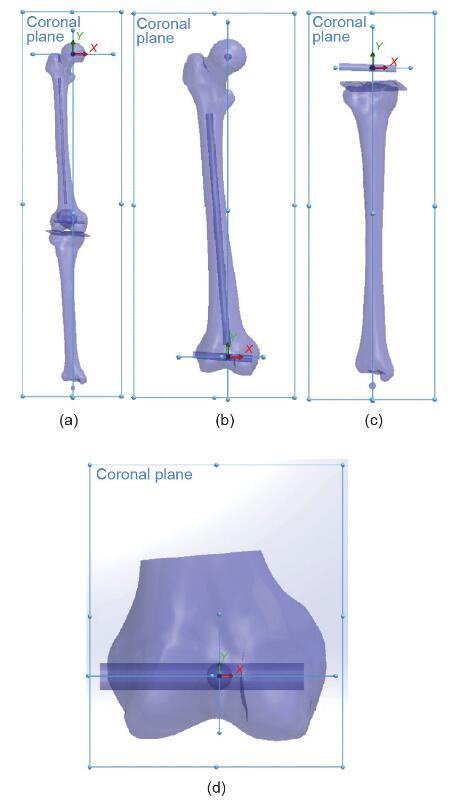 图4. 坐标系示意图。(a)下肢的坐标系;(b)股骨的坐标系;(c)胫骨的坐标系;(d)股骨髁的坐标系。
图4. 坐标系示意图。(a)下肢的坐标系;(b)股骨的坐标系;(c)胫骨的坐标系;(d)股骨髁的坐标系。
© Engineering
整个下肢的冠状平面由穿过髋和踝中心并与NPCA平行的线确定(图4)[17]。垂直于这两条线的第三条线设置为Z轴,并具有前后方向。穿过髋和踝中心的线定义为Y轴。X轴由Y轴和Z轴确定,以形成传统的右手3D 欧几里得坐标系。
股骨的冠状平面由髋关节和NPCA确定(图4)。Z 轴由垂直于冠状平面的线确定,从髋关节的后部到前部。Y轴由穿过膝关节中心和髋关节中心的线确定。X 轴由Y轴和Z轴确定,以形成传统的右手3D欧几里得坐标系。
股骨髁的冠状平面由髋关节中心和NPCA确定(图 4)。Z轴由垂直于冠状平面的线确定,从膝关节中心的后部到前部。X轴由NPCA确定。Y轴由X轴和Z轴确定,以形成传统的右手3D欧几里得坐标系。
胫骨的冠状平面由脚踝中心和NPCA确定(图4)。 Z轴由垂直于冠状平面的线确定,从膝关节中心的后到前。X轴由Y轴和Z轴确定,以形成传统的右手3D欧几里得坐标系。
2.3. 测量参数
尺寸指标参数是膝关节大体解剖的人体测量数据。总共测量了代表下肢标志的36个指标参数,包括股骨的9个参数(见补充材料中的图S1)、股骨髁的23个参数(见补充材料中的图S2)和胫骨切面的4个参数(见补充材料中的图S3)。几何参数是在股骨远端和胫骨近端的部分上测量的参数。在这项研究中,总共测量了90 个指示膝关节特征的几何参数。在股骨髁的切片上,标出内侧和外侧髁的内侧、外侧和大部分下端点[内侧髁的内侧点(CMM)、内侧髁的外侧点(CML)和内侧髁的下端点(CMI)]。使用SolidWorks软件(美国达索系统)根据原点(膝关节中心)测量这些点的二维(2D)坐标(NPCA线上的X尺寸,垂直于NPCA的线上的Y尺寸)(见补充材料中的图S4)。每个参数的数字后缀的规则如下:①−120°截面;②−90°截面;③−70°截面;④−30°截面;⑤ 0°截面和⑥ 40°截面。在髌骨槽的部分,先标记内侧和外侧凹槽的最高点和最低点[分别标记内侧髌骨(PM)、外侧髌骨(PL)和骨凹槽(PG)]。稍后将在X轴内侧和外侧的最高点和最低点之间的凹槽轮廓的中点标记出来[作为髌骨内侧凹槽的内侧点(PMM)和髌骨外侧凹槽的内侧点(PLM)](见补充材料中的图S5)。测量这些点的2D坐标。每个参数的数字后缀的规则如下:① 60°截面;② 90°截面;③ 110°截面和⑥ 40°截面。40°截面是髁和凹槽区域之间的过渡区域。髁和凹槽的融合使外侧髁的内侧点(CLM)和PLM成为同一交汇点,因此它们与CML 和PML点相同。在倾斜5°的胫骨平台表面下方8 mm 的胫骨近端切片上,标出了胫骨内侧后水平(TMY)和胫骨外侧后水平(TLY)。这些点根据原点(膝关节中心)的2D坐标(NPCA线上的X尺寸,垂直于NPCA 的线上的Y尺寸)使用SolidWorks软件测量(见补充材料中的图S6)。
2.4. 统计分析
使用SPSS 20.0软件(IBM,美国)进行数据分析。对指标参数进行Pearson相关性研究。确定了具有高度相关性的索引参数(R2 > 0.7,P < 0.001)。在假体的最终设计中,选择具有最高相关性的指标参数(也易于临床评估)作为基础参数。
进行线性回归分析以确定指标参数和几何参数之间的关系。在线性回归中,使用线性预测函数进行建模,这些函数的未知模型参数是从数据中估计的。线性回归生成公式的系数(及其标准误差和显著性水平),以预测感兴趣特征存在的概率的对数变换:
给定一个从i = 1到i = n的n个统计单位的数据集:
式中,T表示转置,因此图片是向量图片和图片之间的内积;n是统计单位的项数。
线性回归模型假定因变量y与回归变量X的p向量之间的关系是线性的。这种关系是通过扰动项ε建模的,扰动项是一个未观察到的随机变量。
基于一个几何参数和索引参数之间的系数,建立了详细的数学公式[25]。
2.5. 髁突表面重建精度
将重建的股骨髁突表面与原始CT扫描数据中的股骨表面进行比较。对数据库中的十组性别匹配的CT扫描数据(50%的男性和50%的女性)进行了股骨髁突表面的重建。通过获得所有重建表面点至股骨远端的均方根(RMS)距离来完成表面重建精度。重建的髁突表面与原始CT数据匹配。重建的表面和原始股骨数据(STL 文件)被放置在3-matic软件(比利时Materialise公司)中。原始股骨数据和重建的髁突表面的原点和坐标系叠加在一起。使用Mimics 18.0软件中的“零件比较分析”功能,比较了重建的髁突表面与尸体股骨髁突表面之间的RMS距离。
2.6. 骨切除体积测量
最大化保留骨存量是TKR手术的目标之一。使用 3-matic软件将基于中国人口的重建髁突表面的十个个性化股骨组件组装在相应的股骨上。评估所需的骨切除体积。作为对比,将十个商业股骨组件[Mobile Bearing Model(威高,中国)]和另外十个商业股骨组件[Posterior Stabilizing Model(威高,中国)]组装在具有相同尺寸的同一股骨上。再次测量所需的骨切除体积。
2.7. 尸体试验
三具尸体(左下肢)用于尸体试验,以研究:①设计概念;②手术和假体安装的可行性以及③可达到的手术效果。所有尸体都包括从左骨盆到脚的区域。CT扫描以1.25 mm的切片增量和0.702 mm的像素大小进行。
根据全膝关节成形术(TKA)手术的临床实践,对膝关节假体设计原型进行尸体试验。首先进行股骨下切,然后进行后切,然后再进行前切。切槽最后完成。所有削减均在PSI的指导下进行。由具有30年骨科手术经验的经验丰富的外科医生对TKR假体的安装情况进行评估,并检查安装TKR的尸体的运动范围。整个膝关节置换假体和PSI由Fortus 400mc熔融沉积成型机(Stratasys,美国)制造。外科医生将假体安装在尸体骨头上。
3.1. 统计分析
根据第2.3节所述的数据分析,发现上髁宽度(ECW)与大多数关键指标参数[股骨内侧高度(FMH), R2 = 0.749;外侧髁深度(CLD),R2 = 0.847;髁内侧深度(CMD),R2 = 0.849;外侧后高度(PCLH),R2 = 0.791;外侧股骨高度(FLH),R2 = 0.740]密切相关。发现所有关键参数具有显著差异(P < 0.001)。在假体的最终设计中,选择ECW作为基本参数。
3.2. 基于分析的人体测量数据的解剖重建
对于每位受试者/患者,一旦对测量数据进行了分析,我们就可以使用ECW测量的输入通过导出的公式来预测坐标参数。然后可以使用SolidWorks软件进行重建。首先构建测量部分,并通过上述公式将所选参数(测量的解剖学点)绘制在具有分析坐标的特定部分上。
测量的股骨髁数据用于重建过程(见补充材料中的图S7)。通过样条线连接这些点,以模拟髁的平滑曲线。胫骨组件由两部分组成:胫骨托和插入物。类似于股骨髁重建,使用测量和分析的数据重建胫骨托。首先构造胫骨托底座,并根据上述公式将选定的参数(测得的解剖学点)绘制在具有经分析的坐标的特定截面上。根据测量坐标系将胫骨托底部与股骨组件对齐。然后将表面挤出以构建插入物,并根据股骨髁的几何形状设计胫骨托上的凹槽。因此,可以根据中国族群人体测量数据和患者的特定ECW值设计个性化的膝关节假体。
3.3. 髁突表面重建精度
所有数据之间的RMS点到表面(PS)距离为(1.08 ± 0.20)mm(图5和图6)。在所有数据中,髌骨槽区域的RMS PS距离为(1.23 ± 0.27)mm。所有数据中髁后区的RMS PS距离为(0.98 ± 0.30)mm。
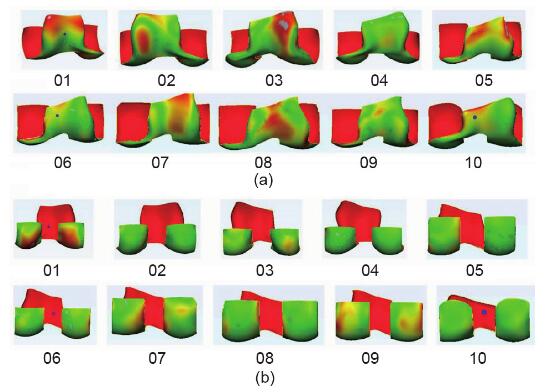 图5.(a)重建的髌骨槽区域的表面匹配精度;(b)重建后髁表面匹配精度。
图5.(a)重建的髌骨槽区域的表面匹配精度;(b)重建后髁表面匹配精度。
© Engineering
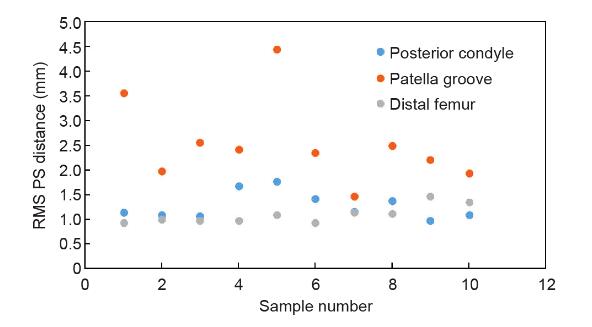 图6. 重建的股骨髁表面的表面匹配精度。
图6. 重建的股骨髁表面的表面匹配精度。
© Engineering
在原始的CT扫描数据中,研究人员还比较了两个基于白种人的商业膝关节假体与股骨髁表面。这些模型是 Mobile Bearing Model和Posterior Stabilizing Model(图 7)。对于Mobile Bearing Model,所有数据之间的RMS PS距离为(2.00 ± 0.50)mm。在所有数据中,髌骨槽区域的RMS PS距离为(3.19 ± 0.96)mm。在所有数据中,后髁区的RMS PS距离为(1.52 ± 0.48)mm。对于 Posterior Stabilizing Model,所有数据之间的RMS PS距离为(2.11 ± 0.41)mm。在所有数据中,髌骨槽区域的RMS PS距离为(3.02 ± 0.74)mm。在所有数据中,后髁区域的RMS PS距离为(1.39 ± 0.39)mm。
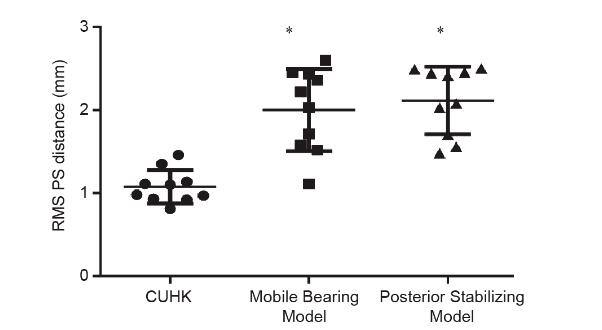 图7. 本研究和商用膝关节假体的表面匹配精度。每组N = 10,单因素方差分析,Dunnett多重比较检验与香港中文大学(CUHK)组相比,差异有统计学意义。
图7. 本研究和商用膝关节假体的表面匹配精度。每组N = 10,单因素方差分析,Dunnett多重比较检验与香港中文大学(CUHK)组相比,差异有统计学意义。
© Engineering
3.4. 骨切除体积测量
根据我们的设计,平均切除的骨量(27 412 mm3 )最小,小于Mobile Bearing系列(30 647 mm3 )和Posterior Stabilizing系列(28 138 mm3 )。
3.5. 尸体试验
所有尸体试验(N = 3)均已成功完成。已成功在尸体中安装了三套TKR假体,包括股骨组件和胫骨组件。股骨组件非常好地覆盖了股骨远端表面,特别是在髁区域。胫骨切开后,胫骨组件的轮廓很好地适合于胫骨近端。安装了TKR假体的尸体膝关节盖能够平稳移动。在试验过程中测试了尸体膝关节的运动范围。所有尸体膝关节都能够从0°旋转到110°,达到了手术标准。TKR 假体运行正常。试验证明了该设计方法的可行性。
本研究分析了中国族群膝关节的3D人体测量数据,并创建了基于中国族群的股骨髁表面重建公式。建立了一种一致性高且可重复的重建髁表面的方法,实现了更精确的假体表面吻合,以更好地保护患者的骨骼。
4.1. 一种基于 X 射线图形一维输入的个性化膝关节假体设计的全新方法
这是一种基于族群的方法来重建股骨髁表面,这种方法不仅可以代表单个患者,而且可以代表同一族群中的多个受试者,被称为特定患者的统计形状模型[26]。
本研究开发了用于人体下肢测量的3D测量全新坐标系系列。坐标系可用于人体下肢的3D测量。可以通过坐标来度量膝关节的定义特征,这与以前的人体测量学研究不同[1–5]。
使用定义的坐标系测量了来自52名受试者的特定参数的3D坐标。线性回归分析后,所有坐标参数均以函数(公式)的形式表示。通过输入特定的ECW,可以根据每个公式的坐标生成假体的形状。在开始制造之前,仅需要一个尺寸即ECW。该尺寸可以在膝关节的前后X射线图像上准确地测量。
目前已经有多种基于族群的3D建模方法,这些方法需要输入患者的2D X射线图像。Zheng和Schumann [27,28]报道了一种使用膝关节的X射线的重建方法。Tang和Lamecker [29,30]还开发了使用双平面图像作为输入的重建方法。Zheng和Schumann [28]、Tang和Ellis [29]以及Sadowsky等[31]进一步开发了使用多平面图像作为输入的重建方法。但是,上述方法对于假体的预制而言效率相对较低,因为需要一定数量的具有特定规格的X射线。此外,这些方法只能从2D图像重建实际的 3D形状。对于骨关节炎患者,有必要在健康状况下重建正常的膝部解剖结构。我们的方法可以在健康条件下重建髁表面,因为在测量过程中仅使用一维ECW进行重建,而正常膝关节用于数据收集。
将本研究中重建的股骨髁表面与原始CT扫描数据中的股骨髁表面进行比较。所有数据之间的RMS PS距离为(1.10 ± 0.18)mm。该结果与其他股骨统计形状建模方法相当。关于股骨模型的RMS PS距离的其他研究包括:距远端股骨模型1.00 mm,使用双平面X射线照片进行轮廓识别(Laporte等[32]);使用单X射线照相法从30个股骨近端模型获得0.80~1.90 mm的范围(Zheng等[28]);使用双平面X射线照相法从20个股骨远端模型获得(2.34 ± 0.82)mm(Tang和Ellis [29]);使用多平面X射线照相法从20个远端股骨模型中取出(1.57 ± 0.50)mm(Tang和Ellis [29])。除了股骨建模结果外,我们的研究还可以与骨盆统计建模结果相媲美,其中包括:使用半自动方法从多个X射线照片上识别出轮廓的骨盆模型,距骨盆模型1.60 mm(Lamecker等 [30]);使用多平面X射线照相法从110个骨盆模型中取出2.08 mm(Sadowsky等[31])。从理论上讲,研究中包含的模型越多,其准确性就越高。但是,Zhu和Li [26] 提出,当模型数量大于25时,3D模型的预测结果是相似的。我们可以得出结论,以一维参数ECW作为输入,我们的股骨远端表面重建精度与使用多平面X射线照片作为输入的研究效果相当。
基于患者的对侧来设计针对患者的假体是目前的常规方法,如在身体的不同部位采用对侧方式进行个性化假体设计[33–35]。本研究中描述的假体设计方法不仅可以代表单个患者,而且可以代表同一族群中的许多受试者,具有极大的创新性。因此不需要患者的对侧侧面图像。换而言之,本研究的假体是根据所测量的52名受试者而不是患者的对侧进行设计的。在双侧畸形或遭受外伤的患者中,身体的对侧可能无法使用,因此难以设计针对患者的假体来治疗这些患者。本研究提出的方法正是用来设计这种情况下的假体。
此外,常规方法是基于CT图像或磁共振(MR)图像来设计患者的专用假体。本研究中提出的方法不需要 CT扫描和MR扫描,从而大大减少了扫描时间和成本。设计假体只需要一个维度,即ECW,就可以轻松、准确地在膝关节的前后X射线图像上对其进行测量。这是假体制造非常实用的方法,因为假体制造商可以预先制造具有不同ECW值的假体。
4.2. 后髁重建与髌骨槽区域重建的比较
在股骨远端的重建表面中,发现髁后部区域(即后圆柱体标记区域)的RMS PS距离为(0.98 ± 0.30) mm,小于髌骨槽区域的RMS PS距离([ 1.23 ± 0.27) mm(图 5)]。在方法学部分中,我们将后圆柱体区域定义为顶部髁间切迹弧的水平切线之后的区域,并进行了分离。
这种现象可以由两个原因来解释。首先,基于后髁圆柱体获取测量参数,包括坐标系的发展。因此,靠近后圆柱体的点更准确。根据我们最近的研究[19],在确定内翻膝关节的股骨轴向排列方面,NPCA比临床上髁轴(CEPA)更可靠。在该研究中,相对于NPCA的所有角度都比相对于CEPA的角度更窄,SD范围更小。这些结果表明,在确定内翻膝关节置换术的轴向和旋转方向时,NPCA作为参考轴比CEPA更可靠。在定义人体测量学的下肢或膝关节坐标系时,NPCA比CEPA更可靠。最近的一项研究报道,形状和排列参数对形态表现有部分影响[18]。该研究表明,基于滑槽分类进行形态分析可能对将来个性化假体的设计有所帮助,这与我们的研究结果相呼应。
4.3. 当前研究与商业假体表面匹配的比较
假体和骨切除表面的精确匹配对于TKA手术至关重要[1]。然而,由于可用的假体尺寸不足,并且中国族群膝关节的人体测量特征没有纳入假体设计中,据报道,许多患者与可用的假体不匹配[2,4]。假体过小会导致假体下陷[36,37],而组件的悬垂会导致软组织磨损,最终导致手术失败[36]。
为了验证使用基于中国族群的方法设计股骨组件的有效性,本研究选择了两个基于白种人的商业膝关节假体,以比较股骨远端表面的准确性。两种商业产品均按比例缩放,以使股骨前后长度与单个CT扫描数据中的相同。整体配准方法是由Mimics 18.0软件提供的功能,用于将假体移动到扫描数据中股骨组件髁表面与股骨远端最合适的位置。与Mobile Bearing Model [(2.00 ± 0.50) mm] 和Posterior Stabilizing Model [(2.11 ± 0.41) mm]相比,本研究设计的股骨组件确保三种产品的准确性最高[RMS PS 为(1.08 ± 0.20) mm]。本研究中设计的股骨组件在后髁匹配[(1.08 ± 0.30) mm]和髌骨槽区域匹配[(1.23±0.27) mm] 方面也比市售的股骨组件表现更好,这些结果表明本研究提出的植入物设计方法可以制造出具有更好的中国族群膝关节表面匹配度的股骨部件,股骨部件可以提供良好的骨覆盖并防止患者受到软组织的撞击[25],结合更好的人体测量数据还可以提高股骨头、植入物的稳定性和寿命[28],并可能减少翻修手术的潜在风险[30]。
4.4. 骨切除体积
减少骨丢失是初级或翻修全膝关节置换术改善固定的最重要挑战之一[38,39]。骨储备量对于将来可能的翻修手术至关重要。因此,保留患者的骨骼结构可以降低将来的翻修手术的难度。此外,Lombardi [4]报道,通过舍弃不必要的骨切除可以避免术中股骨髁骨折。Lukeet等[39]的另一项研究表明减少骨切除体积可以提高骨密度。
从这些研究结果来看,基于族群的组的骨切除体积与Posterior Stabilizing Model组相似,但低于 Mobile Bearing Mode组。当前研究中记录到的平均切除骨量(27 412 mm3 )最小,比Mobile Bearing Model (30 647 mm3 )和Posterior Stabilizing Model(28 138 mm3 )要少,为样本保留了更多的骨头。这些结果与表面匹配分析的结果相呼应。尽管我们无法证明使用我们提出的假体的临床效果,但是可以得出结论,该设计可以保留更多的骨骼,并且一旦需要翻修手术,并发症将更少[4]。
尽管结果表明模型与股骨假体相比具有更好的股骨远端表面匹配精度和较低的骨切除体积,但它并未显示出表面匹配精度与骨切除体积之间的直接关系。因为Mobile Bearing Model的表面匹配精度要优于 Posterior Stabilizing Model,所以记录的Mobile Bearing Model的骨切除体积要大于Posterior Stabilizing Model。这可以通过本研究中进行的组装方法来解释。通过使用整体配准方法来获得假体的最佳匹配位置。根据假体的组装设计,手术期间的实际组装位置可能会略有不同,也会影响切骨量。
4.5. 研究局限
本研究使用的样本是中国南方人。南方人的人体测量学可能与其他地区的中国人不同。将来,本研究将从中国不同地区招募样本,以使我们的数据更能代表中国族群。此外,将不仅包括中国的数据,还包括白种人的数据,以便测量和设计程序更加一致。
本研究所有的假体设计和3D解剖模型均来自CT图像分割。此过程是手动完成的。分割错误可能发生在不清楚的组织边界处。这也归因于图像质量的限制,图像质量不够好,无法区分某些边缘区域的结构。这将导致不正确的3D骨骼模型,从而影响测量参数。
由于设备的限制,本研究没有制造实际的植入式膝关节假体,也没有进行包括疲劳测试、硬度测试和摩擦学测试在内的机械测试来评估假体的设计。
本研究为基于族群的患者特定的股骨假体设计提出了一种新方法。使用单一且易于获取的ECW尺寸作为输入,可以根据分析的测量数据设计特定患者的股骨假体并通过增材制造方法制造。将研究人员的设计与高加索膝关节的商业模型进行比较,结果表明研究人员的设计可获得更高的表面匹配精度和更少的骨切除体积。
知之既深,行之则远。基于全球范围内精湛的制造业专家智囊网络,3D科学谷为业界提供全球视角的增材与智能制造深度观察。有关增材制造领域的更多分析,请关注3D科学谷发布的白皮书系列。
[1] Yue B, Varadarajan KM, Ai ST, Tang TT, Rubash HE, Li GA. Differences of knee anthropometry between Chinese and white men and women. J Arthroplasty 2011;26(1):124–30.
[2] Ho WP, Cheng CK, Liau JJ. Morphometrical measurements of resected surface of femurs in Chinese knees: correlation to the sizing of current femoral implants. Knee 2006;13(1):12–4.
[3] Uehara K, Kadoya Y, Kabayashi A, Ohashi H, Yamana Y. Anthropometry of the proximal tibia to design a total knee prosthesis for the Japanese population. J Arthroplasty 2002;17(8):1028–32.
[4] Lombardi AV Jr, Mallory TH, Waterman RA, Eberle RW. Intercondylar distal femoral fracture. An unreported complication of posterior-stabilized total knee arthroplasty. J Arthroplasty 1995;10:643–50.
[5] Liu Z, Yuan G, Zhang W, Shen Y, Deng L. Anthropometry of the proximal tibia of patients with knee arthritis in Shanghai. J Arthroplasty 2013;28(5):778–83.
[6] Editorial Board of Special Issue on Additive Manufacturing. Introduction to the special issue on additive manufacturing. Engineering 2017;3(5):576.
[7] Wang K, Ho CC, Zhang C, Wang B. A review on the 3D printing of functional structures for medical phantoms and regenerated tissue and organ applications. Engineering 2017;3(5):653–62.
[8] Ling K, Huang G, Liu J, Zhang X, Ma Y, Lu T, et al. Bioprinting-based highthroughput fabrication of three-dimensional MCF-7 human breast cancer cellular spheroids. Engineering 2015;1(2):269–74.
[9] An J, Teoh JEM, Suntornnond R, Chua CK. Design and 3D printing of scaffolds and tissues. Engineering 2015;1(2):261–8.
[10] Lu B, Li D, Tian X. Development trends in additive manufacturing and 3D printing. Engineering 2015;1(1):85–9.
[11] Lipperts M, van Laarhoven S, Senden R, Heyligers I, Grimm B. Clinical validation of a body-fixed 3D accelerometer and algorithm for activity monitoring in orthopaedic patients. J Orthop Translat 2017;11:19–29.
[12] Li L, Long J, Cao H, Tang T, Xi X, Qin L, et al. Quantitative determination of residual 1,4-dioxane in three-dimensional printed bone scaffold. J Orthop Translat 2018;13:58–67.
[13] Bosma SE, Wong KC, Paul L, Gerbers JG, Jutte PC. A cadaveric comparative study on the surgical accuracy of freehand, computer navigation, and patientspecific instruments in joint-preserving bone tumor resections. Sarcoma 2018;2018:4065846.
[14] Mok SW, Nizak R, Fu SC, Ho KWK, Qin L, Saris DBF, et al. From the printer: potential of three-dimensional printing for orthopaedic applications. J Orthop Translat 2016;6:42–9.
[15] Fang C, Cai H, Kuong E, Chui E, Siu YC, Ji T, et al. Surgical applications of threedimensional printing in the pelvis and acetabulum: from models and tools to implants. Unfallchirurg 2019;122(4):278–85.
[16] Eckhoff DG, Bach JM, Spitzer VM, Reinig KD, Bagur MM, Baldini TH, et al. Three-dimensional mechanics, kinematics, and morphology of the knee viewed in virtual reality. J Bone Joint Surg Am 2005;87(S2):71–80.
[17] Eckhoff D, Hogan C, Dimatteo L, Robinson M, Bach J. Difference between the epicondylar and cylindrical axis of the knee. Clin Orthop Relat Res 2007;461:238–44.
[18] Berger RA, Rubash HE, Seel MJ, Thompson WH, Crossett LS. Determining the rotational alignment of the femoral component in total knee arthroplasty using the epicondylar axis. Clin Orthop Relat Res 1993;286:40–7.
[19] Shi D. Biomechanical study on the application of newly defined posterior condylar axis in the kinematical alignment of varus knees [dissertation]. Hong Kong: The Chinese University of Hong Kong; 2015.
[20] Netter FH. Atlas of human anatomy. 6th ed. Philadelphia: Elsevier Saunders; 2014.
[21] Shao X. The manual of anthropometry. Shanghai: Shanghai Lexicographical Publishing House; 1985.
[22] Howell SM, Roth JD, Hull ML. Kinematic alignment in total knee arthroplasty definition, history, principle, surgical technique, and results of an alignment option for TKA. Arthropaedia 2014;1:44–53.
[23] Leardini A, Cappozzo A, Catani F, Toksvig-Larsen S, Petitto A, Sforza V, et al. Validation of a functional method for the estimation of hip joint centre location. J Biomech 1999;32(1):99–103.
[24] Inman VT. The joints of the ankle. Baltimore: Williams & Wilkins; 1976.
[25] Schneider A, Hommel G, Blettner M. Linear regression analysis—part 14 of a series on evaluation of scientific publications. Dtsch Arztebl Int 2010;107 (44):776–82.
[26] Zhu Z, Li G. Construction of 3D human distal femoral surface models using a 3D statistical deformable model. J Biomech 2011;44(13):2362–8.
[27] Zheng G, Schumann S. A system for 3-D reconstruction of a patient-specific surface model from calibrated X-ray images. Stud Health Technol Inform 2009;142:453–8.
[28] Zheng G, Schumann S. 3D reconstruction of a patient-specific surface model of the proximal femur from calibrated X-ray radiographs: a validation study. Med Phys 2009;36(4):1155–66.
[29] Tang TSY, Ellis RE. 2D/3D deformable registration using a hybrid atlas. In: Duncan JS, Gerig G, editors. Lecture notes in computer science. Proceedings of 8th International Conference on Medical Image Computing and ComputerAssisted Intervention; 2005 Oct 26–29; Palm Springs, CA, USA. Berlin: Springer-Verlag; 2005. p. 223–30.
[30] Lamecker H, Seebass M, Hege HC, Deuflhard PA. In: Image processing. Proceedings of the Medical Imaging 2004 Conference; 2004 Feb 17–19; San Diego, CA, USA. Bellingham: Spie-Int Soc Optical Engineering; 2004. p. 1341–51.
[31] Sadowsky O, Chintalapani G, Taylor RH. Deformable 2D-3D registration of the pelvis with a limited field of view, using shape statistics. In: Ayache, N, Ourdelin S, Maeder A, editors. Lecture notes in computer science. Proceedings of 10th International Conference on Medical Image Computing and ComputerAssisted Intervention; 2007 Oct 29–Nov 2; Brisbane, QLD, Australia. Berlin: Springer-Verlag; 2007. p. 519–26.
[32] Laporte S, Skalli W, de Guise JA, Lavaste F, Mitton D. A biplanar reconstruction method based on 2D and 3D contours: application to the distal femur. Comput Methods Biomech Biomed Eng 2003;6(1):1–6.
[33] Vignesh U, Mehrotra D, Howlader D, Singh PK, Gupta S. Patient specific threedimensional implant for reconstruction of complex mandibular defect. J Craniofac Surg 2019;30(4):E308–11.
[34] Tarsitano A, Badiali G, Pizzigallo A, Marchetti C. Orbital reconstruction: patient-specific orbital floor reconstruction using a mirroring technique and a customized titanium mesh. J Craniofac Surg 2016;27(7):1822–5.
[35] Du H, Tian X, Li T, Yang J, Li K, Pei G, et al. Use of patient-specific templates in hip resurfacing arthroplasty: experience from sixteen cases. Int Orthop 2013;37(5):777–82.
[36] Hitt K, Shurman JR, Greene K, McCarthy J, Moskal J, Hoeman T, et al. Anthropometric measurements of the human knee: correlation to the sizing of current knee arthroplasty systems. J Bone Joint Surg Am 2003;85(S4):115–22.
[37] Westrich GH, Agulnick MA, Laskin RS, Haas SB, Sculco TP. Current analysis of tibial coverage in total knee arthroplasty. Knee 1997;4(2):87–91.
[38] Hoaglund FT, Low WD. Anatomy of the femoral neck and head with comparative data from Caucasians and Hong Kong Chinese. Clin Orthop Relat Res 1980;152:10–6.
[39] Luke P, Allison R, Joseph L, Timothy W, Mark G, Geoffrey W. Reduction in bone volume resection with a newer posterior stabilized total knee arthroplasty design. HSS J 2013;9(2):157–60.
l 谷专栏 l
欢迎高校及科研机构、企业科学家加入谷专栏,与业界分享对推动增材制造发展起关键作用的共性基础科研与应用成果,欢迎扫描下方图片二维码提交您的信息。
白皮书下载 l 加入3D科学谷QQ群:106477771
网站投稿 l 发送至2509957133@qq.com
欢迎转载 l 转载请注明来源3D科学谷 l 链接到3D科学谷网站原文。