近日,比利时根特大学Sandra Van Vlierberghe课题组开发了一种基于巯基-烯化学反应实现光交联的聚ε-己内酯(PCL)材料体系,并利用该材料体系首次实现了生物可降解聚酯材料的高分辨率体积3D打印。作者制备出了迄今为止最小的体积3D打印巯基-烯交联聚ε-己内酯材料。相对于传统丙烯酸酯交联的聚ε-己内酯材料来说,这种材料的力学性能提高了10倍以上,材料的交联程度及性能具有灵活的可调性。这项研究为在高分辨率下快速制造定制化的医疗植入物开辟了一条新途径。相关研究成果发表于Advanced Materials上,文章链接DOI:10.1002/adma.202210136
随着组织工程学和再生医学的快速发展,越来越多生物材料用于修复组织损伤。近年来,为了克服传统组织工程技术面临的问题,医学界提出了原位组织再生修复的概念,该技术是将具有生物降解特性的支架直接植入到体内缺损部位,利用支架材料固有的生物学活性和诱导分化能力来促进体内细胞的迁移、增殖和分化来实现缺损组织的修复。待受损组织修复后,植入的支架材料缓慢降解,损伤的机体恢复如初。聚已内酯作为一种优良的生物医用材料,具有良好的柔韧性、可加工性、生物相容性和可生物降解性,植入人体后对人体免疫系统无明显影响,在体内降解后没有残留,对于制造医疗植入物是很好的选择。
体积3D打印技术(volumetric 3D-printing, VP)是指将特定图案的光直接投影到连续旋转的树脂中,实现树脂固化成型。相对于传统的光固化3D打印技术(例如:DLP数字光处理),体积3D打印技术具有成型时间短(仅需数十秒)、分辨率高(可达微米级)、打印复杂结构无需支撑并兼容高粘度(大于4 Pa·s)的树脂墨水等优势,因此非常适合于特殊病人医疗植入物的高效定制。
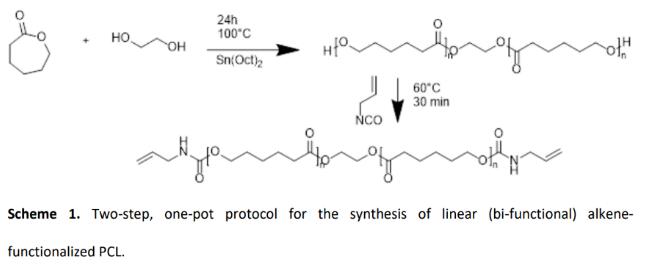
利用光固化3D打印技术实现聚ε-己内酯材料的成型,一般需要在聚ε-己内酯的分子链上引入可以实现光交联的官能团。目前,这方面的研究都是通过在聚ε-己内酯分子链上引入丙烯酸酯基团来实现。然而,丙烯酸酯交联的聚ε-己内酯材料存在脆性大、力学性能不佳的缺点(断裂强度< 2 MPa,断裂伸长率< 49%)。为了克服这一限制,比利时根特大学Sandra Van Vlierberghe课题组将巯基-烯交联引入聚ε-己内酯材料,开发了一种新的材料体系。所制备的材料与目前性能最好的光交联聚ε-己内酯材料相比,断裂强度和断裂伸长率提高了10倍以上。这种结果归因于交联网络中均匀的拓扑结构以及所涉及的阶跃生长聚合机制。在本文中,作者实现了这种材料的高分辨率体积3D打印,3D打印结构的交联网络具有可调性并展现出优异的力学性能。在具体的研究中,作者首先通过两步、一锅法合成了两端具有烯烃官能团的线性聚ε-己内酯(Scheme 1),并通过核磁共振谱图确认了目标产物的化学结构(Figure 1)。
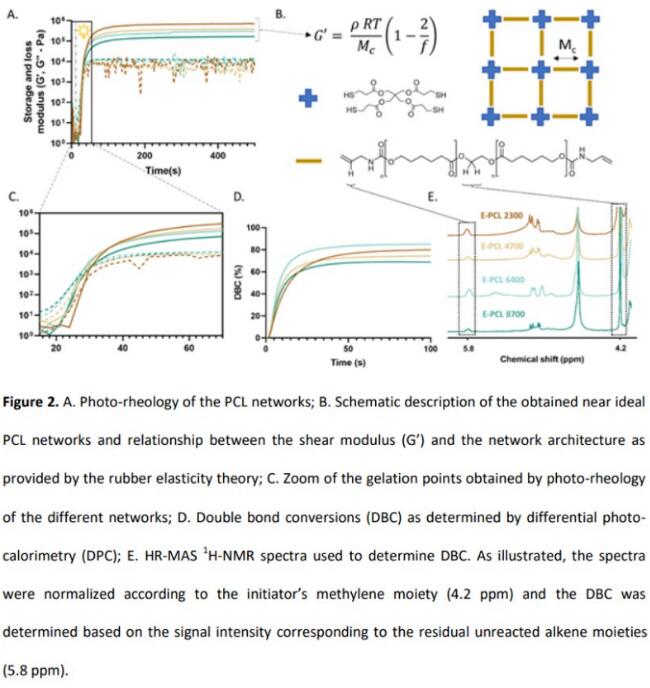
作者进一步将两端具有烯烃官能团的线性聚ε-己内酯与具有四个巯基官能团的交联剂混合,制备了可光交联的聚ε-己内酯材料体系。通过控制线性聚ε-己内酯分子链的长度(Mc),可以方便地调节交联网络的疏密程度。作者研究了具有不同Mc的聚ε-己内酯材料的光流变性(Figure 2)。实验数据表明,Mc对凝胶点(即G’和G”的交点坐标)没有明显的影响,较高的Mc仅能使凝胶点出现的时间略微延迟。基于橡胶弹性理论,可以实现对阶跃生长的交联聚合物网络进行预测,以获得与预期目标相符的聚ε-己内酯交联网络。作者研究了具有不同交联程度的聚ε-己内酯材料的耐候性能、力学强度和可生物降解性。
作者研究了线性聚ε-己内酯分子链的长度(Mc)对交联材料各方面性能的影响。Mc 越小交联密度越高,Mc越大交联密度越低。DSC数据表明,随着Mc的增加,巯基-烯交联的聚ε-己内酯的熔融温度呈上升趋势(Figure 3A)。加速降解试验(即将材料暴露于5 M NaOH中)的结果表明降解速率对Mc有很强的依赖性,更高的交联密度(即降低Mc)会加速降解(Figure 3B)。为了模拟材料在生理条件下的降解行为,将材料在37 °C的磷酸盐缓冲液中降解一个月。结果表明,在各种交联程度的材料中都没有明显的降解发生(Figure 3C)。应力-应变曲线显示,材料在拉伸过程中会发生明显的塑性变形,随着Mc的增加塑性变形更加明显(Figure 3D)。与丙烯酸酯交联的聚ε-己内酯材料相比,本研究开发的巯基-烯交联聚ε-己内酯材料在断裂伸长率和断裂强度方面均有明显的提升(Figure 3E, F)。
基于体积3D打印技术,作者将定制图案投影到双烯烃官能化的线性聚ε-己内酯与四巯基交联剂的混合墨水中,实现了快速、高分辨率地制备定制化的三维结构。作者对打印参数进行了优化,同时制定了打印结构的筛选标准(Figure 4)。按照作者制定的筛选标准,3D打印的管状结构通常可以被划分为三种状态。过短的投影时间会导致打印产物成为一个未完全固化的团聚物,未固化的部分粘性很大并没有预期的规整形状;相反,过长的投影时间导致管状产品中央的孔道也被固化的树脂所填充;合适的投影时间可以使3D打印的管状结构具有符合预期的完美形状和较高的规整度。
作者基于所开发的巯基-烯交联聚ε-己内酯材料体系,通过体积3D打印技术制备了复杂的金刚石晶体三维结构和人工血管结构(Figure 5)。该血管结构具有900 μm的中心通道和400 μm的壁厚,证实所开发的材料体系可以通过体积3D打印技术实现高精度的成型。并且3D打印的结构具有丰富的微观孔隙,利于人体细胞的迁入和组织的再生与修复。
最后,作者评估了3D打印聚ε-己内酯结构的生物相容性和细胞毒性。体外和体内实验结果表明,3D打印结构对小鼠干细胞的活力和代谢活性以及小鼠的健康没有明显的影响(Figure 6)。因此,通过体积3D打印技术制备的巯基-烯交联聚ε-己内酯结构是无毒和完全生物相容的。
Sandra Van Vlierberghe课题组开发了基于巯基-烯化学反应实现光交联的聚ε-己内酯材料体系,并首次实现了生物可降解聚酯材料的体积3D打印。基于先进的体积3D打印技术,可以在高分辨率下快速制备具有定制化外形的复杂结构。在本研究中,作者实现了巯基-烯交联聚ε-己内酯材料体系迄今为止最高分辨率的3D打印。这项研究为高效制造具有定制化结构的可降解医疗植入物开辟了新的途径。
文中图片来源:Adv. Mater.
l 谷专栏 l
欢迎高校及科研机构、企业科学家加入谷专栏,与业界分享对推动增材制造发展起关键作用的共性基础科研与应用成果,欢迎扫描下方图片二维码提交您的信息。
白皮书下载 l 加入3D科学谷QQ群:106477771
网站投稿 l 发送至2509957133@qq.com
欢迎转载 l 转载请注明来源3D科学谷 l 链接到3D科学谷网站原文。